
分析 (1)金属阳离子和阴离子之间的化学键为离子键,一般盐、碱金属氧化物中含有离子键,非金属元素之间的化学键为共价键,其中相同非金属元素形成的为非极性共价键,不同非金属元素形成的为极性共价键,以此解答该题;
(2)32号元素核外电子排布为4s24p2,所以在第四周期第ⅣA 族;
(3)根据题干信息判断该无氧酸盐为氯化钾,再根据化合价变化判断另一种无氧酸盐名称,最后根据化合价升降相等配平即可.
解答 解:(1)NaCl中钠离子和氯离子之间只存在离子键;
NaOH中钠离子和氢氧根离子之间存在离子键、O原子和氢原子之间存在极性共价键;
Na2O2中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在非极性共价键;
H2S是共价化合物;
H2O2中H原子和O原子之间只存在极性共价键,O与O原子之间为非极性键;
N2中N原子之间只存在非极性共价键;
故答案为:NaOH;Na2O2;
(2)32号元素核外电子排布为4s24p2,所以在第四周期第ⅣA 族,故答案为:第四周期第ⅣA 族;
(3)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,则该无氧酸为KCl,KCl中氯元素化合价为-1,说明氯酸钾中氯元素化合价降低,则另一种含氧酸盐中氯元素化合价会升高,由于氯酸钾中氯元素化合价为+5,则氯元素化合价升高只能被氧化成高氯酸钾,根据氧化还原反应中化合价升降相等配平该反应为:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4,故答案为:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
点评 本题考查较综合,涉及同一周期中元素周期律与原子结构的关系、化学方程式的书写等知识,注重高频考点的考查,题目难度较大,有利于培养学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的化合物可能含有非极性键 | |
| B. | X的单质与Z的单质在暗处能剧烈反应 | |
| C. | 含W的盐溶于水形成的溶液一定显酸性 | |
| D. | 离子半径:r(Z-)>r(W3+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知X、Y是两种性质相似的短周期元素.
已知X、Y是两种性质相似的短周期元素. ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存,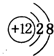 .(2)Y元素在周期表中位置第三周期ⅢA族.
.(2)Y元素在周期表中位置第三周期ⅢA族. ,X是形成化合物种类最多的元素.
,X是形成化合物种类最多的元素.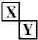 ,X、Y的最高价含氧酸的浓溶液都有强氧化性.
,X、Y的最高价含氧酸的浓溶液都有强氧化性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性 | |
| B. | N2是大气中的主要成分之一,雷雨时,可直接转化为NO2 | |
| C. | Cl2能与金属活动顺序表中大多数金属反应 | |
| D. | 硅是应用广泛的半导体材料,常温下化学性质活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者都是酸性氧化物,故均不与酸反应 | |
| B. | 两者都可以与NaOH溶液反应 | |
| C. | CO2 的溶沸点比SiO2高 | |
| D. | 两者都能与水反应生成对应的酸且碳酸的酸性大于硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹是一种有色固体,它的气态氢化物很不稳定 | |
| B. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| C. | 铷的硫酸盐易溶解于水,其氢氧化物一定是强碱 | |
| D. | 氯化氢比溴化氢稳定,HClO4酸性强于HBrO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com