
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬½«Ä³Ņ»ŌŖĖįHAŗĶNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬Į½ÖÖČÜŅŗµÄÅضČŗĶ»ģŗĻŗóĖłµĆČÜŅŗµÄpHČēĻĀ±ķ£¬Ēė»Ų“š£ŗ
ŹµŃ鱹ŗÅ | HAĪļÖŹµÄĮæÅØ¶Č (mol”¤L-1) | NaOHĪļÖŹµÄĮæÅضČ(mol”¤L-1) | »ģŗĻČÜŅŗµÄpH |
¼× | 0.2 | 0.2 | pH£½a |
ŅŅ | c | 0.2 | pH£½7 |
±ū | 0.2 | 0.1 | pH£¾7 |
¶” | 0.1 | 0.1 | pH£½9 |
£Ø1£©²»æ¼ĀĒĘäĖü×éµÄŹµŃé½į¹ū£¬µ„“Ó¼××éĒéæö·ÖĪö£¬ČēŗĪÓĆa (»ģŗĻČÜŅŗµÄpH)Ą“ĖµĆ÷HAŹĒĒæĖį»¹ŹĒČõĖį_________________________________________________”£
£Ø2£©²»æ¼ĀĒĘäĖü×éµÄŹµŃé½į¹ū£¬µ„“ÓŅŅ×éĒéæö·ÖĪö£¬CŹĒ·ńŅ»¶ØµČÓŚ0.2______(Ń”Ģī”°ŹĒ”±»ņ”°·ń”±)”£»ģŗĻŅŗÖŠĄė×ÓÅضČc(A£)Óė c(Na+)µÄ“󊔹ŲĻµŹĒ____________________”£
£Ø3£©±ū×鏵Ńé½į¹ū·ÖĪö£¬HAŹĒ________Ėį£ØŃ”Ģī”°Ēæ”±»ņ”°Čõ”±£©”£øĆ»ģŗĻČÜŅŗÖŠĄė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņŹĒ________________________________”£
£Ø4£©¶”×鏵ŃéĖłµĆ»ģŗĻČÜŅŗÖŠÓÉĖ®µēĄė³öµÄc(OH£)£½_____________mol”¤L-1”£Š“³öøĆ»ģŗĻČÜŅŗÖŠµÄĻĀĮŠĖćŹ½µÄ¾«Č·½į¹ū (Źż¾Ż²»ÄÜ×ö½üĖĘ¼ĘĖć£¬²»ÓĆ»Æ¼ņ)”£c(Na+)£c(A-)£½____________mol”¤L-1 c(OH-)£c(HA)£½____________mol”¤L-1
”¾“š°ø”æ a=7Ź±£¬HAŹĒĒæĖį£»a£¾7Ź±£¬HAŹĒČõĖį ·ń c(Na+) =c(A£) Čõ c(Na+) £¾c(A£) £¾ c(OH£) £¾c(H+) 10”Ŗ5 10”Ŗ5”Ŗ10”Ŗ9 10”Ŗ9
”¾½āĪö”æ£Ø1£©Ņ»ŌŖĖįHAŗĶNaOHČÜŅŗµČĢå»ż»ģŗĻ£¬Į½ÖÖČÜŅŗµÄĪļÖŹµÄĮæÅØ¶Č¶¼ĪŖ0.2mol/L£¬ŌņĖį¼īµÄĪļÖŹµÄĮæĻąµČ£¬Čēa=7£¬ĖµĆ÷·“Ó¦ŗóČÜŅŗ³ŹÖŠŠŌ£¬ŌņHAŹĒĒæĖį£¬Čēa£¾7£¬·“Ó¦ŗó³Ź¼īŠŌ£¬ŌņHAŹĒČõĖį£»£Ø2£©·“Ó¦ŗóČÜŅŗ³ŹÖŠŠŌ£¬ČēHAĪŖĒæĖį£¬Ōņc=0.2£¬ČēHAĪŖČõĖį£¬Ōņc£¾0.2£¬½ö“ÓŅŅ×éĒéæö·ÖĪö£¬c²»Ņ»¶ØµČÓŚ0.2£¬ÓÉÓŚ·“Ó¦ŗóČÜŅŗ³ŹÖŠŠŌ£¬ŌņÓŠc£ØOH-£©=c£ØH+£©£¬øł¾ŻČÜŅŗ³ŹÖŠŠŌ£¬ŌņÓŠc£ØNa+£©+c£ØH+£©=c£ØA-£©+c£ØOH-£©£¬ĖłŅŌc(Na+) =c(A£)£»£Ø3£©µČĪļÖŹµÄĮæµÄĖį¼ī·“Ó¦ŗóČÜŅŗ³Ź¼īŠŌ£¬ÓÉÓŚNaOHĪŖĒæ¼ī£¬ŌņøĆĖįĪŖČõĖį£¬ŌŚČÜŅŗÖŠ“ęŌŚA-+H2OHA+OH-£¬Ōņc(Na+) =c(A£)£¬ČÜŅŗ³Ź¼īŠŌ£¬Ōņc£ØOH-£©£¾c£ØH+£©£¬Ņ»°ćĄ“Ėµ£¬ŃĪĄąµÄĖ®½ā³Ģ¶Č½ĻµĶ£¬ŌņÓŠc£ØA-£©£¾c£ØOH-£©£¬ĖłŅŌÓŠ£ŗc£ØNa+£©£¾c£ØA-£©£¾c£ØOH-£©£¾c£ØH+£©£»£Ø4£©ČÜŅŗµÄpH=9£¬ŌņĒāĄė×ÓÅضČĪŖ10-9 mol/L£¬µČĪļÖŹµÄĮæµÄĖį¼ī·“Ó¦ŗóČÜŅŗ³Ź¼īŠŌ£¬ČÜŅŗÖŠĒāŃõøłĄė×ÓČ«²æĄ“×ŌÓŚČõĖįøłĄė×ÓĖ®½āµĆµ½µÄ£¬c£ØOH-£©=  =
= ![]() =10-5 mol/L£¬Ņ»ŌŖĖįHAŗĶNaOHČÜŅŗµČĢå»ż»ģŗĻÉś³ÉNaAČÜŅŗ£¬ČÜŅŗÖŠ“ęŌŚµēŗÉŹŲŗć£ŗc£ØNa+£©+c£ØH+£©=c£ØOH-£©+c£ØA-£©£¬ŅĄ¾ŻÉĻŹö¼ĘĖćµĆµ½£ŗc£ØNa+£©-c£ØA-£©=c£ØOH-£©-c£ØH+£©=(10-5-10-9) mol”¤L-1£» ŅĄ¾ŻČÜŅŗÖŠµēŗÉŹŲŗćŗĶĪļĮĻŹŲŗćµĆµ½£ŗc£ØNa+£©+c£ØH+£©=c£ØOH-£©+c£ØA-£©£¬c£ØNa+£©=c£ØA-£©+c£ØHA£©£¬ŗĻ²¢µĆµ½c£ØOH-£©-c£ØHA£©=c£ØH+£©=10-9 mol”¤L-1”£
=10-5 mol/L£¬Ņ»ŌŖĖįHAŗĶNaOHČÜŅŗµČĢå»ż»ģŗĻÉś³ÉNaAČÜŅŗ£¬ČÜŅŗÖŠ“ęŌŚµēŗÉŹŲŗć£ŗc£ØNa+£©+c£ØH+£©=c£ØOH-£©+c£ØA-£©£¬ŅĄ¾ŻÉĻŹö¼ĘĖćµĆµ½£ŗc£ØNa+£©-c£ØA-£©=c£ØOH-£©-c£ØH+£©=(10-5-10-9) mol”¤L-1£» ŅĄ¾ŻČÜŅŗÖŠµēŗÉŹŲŗćŗĶĪļĮĻŹŲŗćµĆµ½£ŗc£ØNa+£©+c£ØH+£©=c£ØOH-£©+c£ØA-£©£¬c£ØNa+£©=c£ØA-£©+c£ØHA£©£¬ŗĻ²¢µĆµ½c£ØOH-£©-c£ØHA£©=c£ØH+£©=10-9 mol”¤L-1”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠÓŠ¹ŲŹµŃé²Ł×÷»ņ²āĮæŹż¾ŻµÄĖµ·ØÕżČ·µÄŹĒ( )
A.ÓĆĶŠÅĢĢģĘ½³ĘĮæŹ³ŃĪµÄÖŹĮæĪŖ12.35gB.ÖŠŗĶČČµÄ²ā¶ØŹµŃéÖŠ£¬NaOHČÜŅŗÓ¦øĆÉŌ¹żĮæ
C.ÓĆpHŹŌÖ½²āĮæ“ĪĀČĖįÄĘČÜŅŗµÄpHĪŖ11D.ÓĆ¼īŹ½µĪ¶Ø¹ÜĮæČ”øßĆĢĖį¼ŲČÜŅŗ20.00mL
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijĮņĖį³§·ĻĘųÖŠSO2µÄ»ŲŹÕĄūÓĆ·½°øČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©

A. XæÉÄÜŗ¬ÓŠ2ÖÖŃĪ
B. ĘųĢåaĶØČėĖ«ŃõĖ®£¬æÉŹµĻÖ”°ĀĢÉ«”±×Ŗ»Æ
C. YÖ÷ŅŖŗ¬ÓŠ£ØNH4£©2SO4£¬»ŲŹÕĄūÓĆ×÷»Æ·Ź
D. £ØNH4£©2S2O8ÖŠSµÄ»ÆŗĻ¼ŪĪŖ+7
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗŹµŃéŹŅæɹ©Ń”ŌńµÄÓĆÓŚČ„³żĘųĢåŌÓÖŹµÄŹŌ¼ĮÓŠ£ŗÅØĮņĖį”¢ĪŽĖ®ĀČ»ÆøĘ”¢ĪåŃõ»Æ¶žĮ×”¢¼īŹÆ»Ņ£ØÖ÷ŅŖ³É·ÖĪŖNaOHŗĶCaO£© 
¢ŁŹµŃéŹŅÓĆČēĶ¼1ĖłŹ¾×°ÖĆ½ųŠŠ“æ¾»øÉŌļµÄĒāĘų»¹ŌŃõ»ÆĢśŹµŃ飮a×°ÖĆĆū³ĘĪŖ £¬ ·½æņBČӦєÓĆČēĶ¼2×°ÖĆ£ØĢī”°¢ń”±»ņ”°¢ņ”±£©£¬Ń”ÓĆµÄ³żŌÓŹŌ¼ĮĪŖ£ØĢīŹŌ¼ĮĆū³Ę£©£®
¢ŚŹµŃéŹŅ³£ÓĆ36.5%ÅØŃĪĖį£Ø¦Ń=1.2gcm©3£©ÅäÖĘĻ”ŃĪĖį£¬ČōŅŖÅäÖĘ500mL£¬0.5molL©1Ļ”ŃĪĖį£¬ŠčÓĆĮæĶ²Č”ÓĆÅØŃĪĖįmL£®
¢ŪŠ“³ö×°ÖĆCÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½²¢ÓƵ„ĻßĒűźĆ÷µē×ÓµÄ×ŖŅĘ £® ŹµŃé½įŹųŹ±Ó¦øĆ²ÉČ”µÄ²Ł×÷ŹĒ £®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ»ÆŗĻĪļŹōÓŚŃĪµÄŹĒ
A.FeO(OH)B.(CH3CO)2OC.CaCl2OD.Na2O2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŖĖŲXµÄµ„ÖŹ¼°XÓėŌŖĖŲYŠĪ³ÉµÄ»ÆŗĻĪļ“ęŌŚČēĶ¼ĖłŹ¾µÄ¹ŲĻµ£ØĘäÖŠm”Łn£¬ĒŅ¾łĪŖÕżÕūŹż£©£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
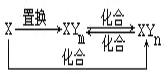
A. XŅ»¶ØŹĒ½šŹōŌŖĖŲ
B. £Øn-m£©Ņ»¶ØµČÓŚ1
C. ÓÉXÉś³É1molXYmŹ±×ŖŅʵĵē×ÓŹżÄæŅ»¶ØĪŖ4NA
D. Čżøö»ÆŗĻ·“Ó¦Ņ»¶Ø¶¼ŹĒŃõ»Æ»¹Ō·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijMgCl2ČÜŅŗµÄĆܶČĪŖ1.6g”¤cm-3£¬ĘäÖŠĆ¾Ąė×ÓµÄÖŹĮæ·ÖŹżĪŖ10 %£¬300 mLøĆČÜŅŗÖŠCl-Ąė×ÓµÄĪļÖŹµÄĮæŌ¼µČÓŚ
A. 4.0 mol B. 3.0 mol C. 2.0 mol D. 1.0 mol
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ”°µĶĢ¼Ń»·”±ŅżĘšø÷¹śµÄø߶ČÖŲŹÓ£¬ŅŃÖŖĆŗ”¢¼×ĶéµČæÉŅŌÓėĖ®ÕōĘų·“Ӧɜ³ÉŅŌCOŗĶH2ĪŖÖ÷µÄŗĻ³ÉĘų£¬ŗĻ³ÉĘųÓŠ¹ć·ŗÓ¦ÓĆ”£ŹŌ»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©øßĀÆĮ¶ĢśŹĒCOĘųĢåµÄÖŲŅŖÓĆĶ¾Ö®Ņ»£¬Ę仳±¾·“Ó¦ĪŖ£ŗ
FeO(s)£«CO(g) ![]() Fe(s)£«CO2(g)””¦¤H£¾0”£
Fe(s)£«CO2(g)””¦¤H£¾0”£
ŅŃÖŖŌŚ1100 ”ꏱ£¬øĆ·“Ó¦µÄ»ÆŃ§Ę½ŗā³£ŹżK£½0.263”£
¢ŁĪĀ¶ČÉżøߣ¬»ÆŃ§Ę½ŗāŅʶÆŗó“ļµ½ŠĀµÄĘ½ŗā£¬“ĖŹ±Ę½ŗā³£ŹżKÖµ________(Ģī”°Ōö“ó”±”¢”°¼õŠ””±»ņ”°²»±ä”±)£»
¢Ś1100 ”ꏱ²āµĆøßĀÆÖŠ£¬[CO2]£½0.025 mol”¤L£1£¬[CO]£½0.1 mol”¤L£1£¬ŌņŌŚÕāÖÖĒéæöĻĀ£¬øĆ·“Ó¦Ļņ______½ųŠŠ(Ģī”°×ó”±»ņ”°ÓŅ”±)£¬ÅŠ¶ĻŅĄ¾ŻŹĒ__________________________”£
£Ø2£©ÄæĒ°¹¤ŅµÉĻŅ²æÉÓĆCO2Ą“Éś²śČ¼ĮĻ¼×“¼£¬ÓŠ¹Ų·“Ó¦ĪŖ£ŗCO2(g)£«3H2(g) ![]() CH3OH(g)£«H2O(g)””¦¤H£½£49.0 kJ”¤mol£1£¬ĻÖĻņĢå»żĪŖ1 LµÄĆܱÕČŻĘ÷ÖŠ£¬³äČė1 mol CO2ŗĶ3 mol H2£¬·“Ó¦¹ż³ĢÖŠ²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼äµÄ±ä»ÆČēĶ¼ĖłŹ¾”£
CH3OH(g)£«H2O(g)””¦¤H£½£49.0 kJ”¤mol£1£¬ĻÖĻņĢå»żĪŖ1 LµÄĆܱÕČŻĘ÷ÖŠ£¬³äČė1 mol CO2ŗĶ3 mol H2£¬·“Ó¦¹ż³ĢÖŠ²āµĆCO2ŗĶCH3OH(g)µÄÅضČĖꏱ¼äµÄ±ä»ÆČēĶ¼ĖłŹ¾”£
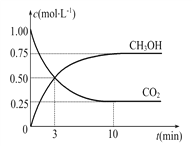
¢Ł“Ó·“Ó¦æŖŹ¼µ½Ę½ŗā£¬ĒāĘųµÄĘ½¾ł·“Ó¦ĖŁĀŹv(H2)£½____”£
¢Ś·“Ó¦“ļµ½Ę½ŗāŗó£¬ĻĀĮŠ“ėŹ©ÄÜŹ¹![]() Ōö“óµÄŹĒ_____(Ģī·ūŗÅ)”£
Ōö“óµÄŹĒ_____(Ģī·ūŗÅ)”£
A.ÉżøßĪĀ¶Č”””” B.ŌŁ³äČėH2”””” C.ŌŁ³äČėCO2
D.½«H2O(g)“ÓĢåĻµÖŠ·ÖĄė”””””” E.³äČėHe(g)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·ØÖŠ£¬“ķĪóµÄŹĒ
A”¢»Æѧ·“Ó¦±ŲČ»°éĖęÄÜĮæ±ä»Æ
B”¢Šč¼ÓČČ²ÅÄÜ·¢ÉśµÄ»Æѧ·“Ó¦Ņ»¶ØŹĒĪüČČ·“Ó¦
C”¢»Æѧ·“Ó¦ÖŠµÄÄÜĮæ±ä»ÆÖ÷ŅŖŹĒÓÉ»Æѧ¼üµÄ¶ĻĮŃŗĶŠĪ³ÉŅżĘšµÄ
D”¢·“Ó¦ĪļÓėÉś³ÉĪļ×ÜÄÜĮæµÄĻą¶Ō“󊔾ö¶Ø·“Ó¦ŹĒĪüČČ»ņ·ÅČČ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com