
·ÖĪö £Ø1£©A”¢B”¢C”¢D¾łĪŖ¶ąŗĖ10µē×ÓĪ¢Į££¬ĘäÖŠAĪŖŃōĄė×Ó£¬BĪŖŅõĄė×Ó£¬C”¢D¾łĪŖ·Ö×Ó£¬ĒŅCµÄĻą¶Ō·Ö×ÓÖŹĮæ±ČD“ó1£¬Ó¦ĪŖNH4+ŗĶOH-µÄ·“Ó¦£¬Éś³ÉNH3ŗĶH2O£»
£Ø2£©¢Ł2CH3OH£Øl£©+3O2£Øg£©=2CO2£Øg£©+4H2O£Øg£©”÷H=-a kJ•mol-1
¢Ś2CO£Øg£©+O2£Øg£©=2CO2£Øg£©”÷H=-b kJ•mol-1
¢ŪH2O£Øg£©=H2O£Øl£©”÷H=-c kJ•mol-1
½įŗĻøĒĖ¹¶ØĀɼĘĖć£¬£Ø¢Ł-¢Ś+4”Į¢Ū£©”Į$\frac{1}{2}$µĆµ½CH3OH£Øl£©+O2£Øg£©=CO£Øg£©+2H2O£Øl£©·“Ó¦µÄģŹ±ä£»
£Ø3£©¶ŌĀĖŅŗ¼ÓŹŌ¼ĮČō²»·¢Éś·“Ó¦£¬Ōņ³ĮµķŅŃ¾ĶźČ«£»ŌŚ¹żĀĖĘ÷ÉĻĻ“µÓ³Įµķ£¬Ź¹ÕōĮóĖ®½žĆ»³Įµķ£¬Ė®×ŌČ»Į÷ĻĀ£¬ŅŌ“ĖĄ“½ā“š£»
£Ø4£©ĢśĄė×ÓĖ®½āÉś³É½ŗĢ壬¾ßÓŠĪüø½ŠŌ£»ĖįŠŌČÜŅŗÖŠŅÖÖĘĄė×ÓµÄĖ®½ā£®
½ā“š ½ā£ŗ£Ø1£©A”¢B”¢C”¢D¾łĪŖ¶ąŗĖ10µē×ÓĪ¢Į££¬ĘäÖŠAĪŖŃōĄė×Ó£¬BĪŖŅõĄė×Ó£¬C”¢D¾łĪŖ·Ö×Ó£¬ĒŅCµÄĻą¶Ō·Ö×ÓÖŹĮæ±ČD“ó1£¬Ó¦ĪŖNH4+ŗĶOH-µÄ·“Ó¦£¬Éś³ÉNH3ŗĶH2O£»
¢ŁA+B”śC+D±ķŹ¾µÄĄė×Ó·½³ĢŹ½ĪŖNH4+ŗĶOH-µÄ·“Ó¦£¬·½³ĢŹ½ĪŖNH4++OH- $\frac{\underline{\;\;”÷\;\;}}{\;}$NH3”ü+H2O£¬
¹Ź“š°øĪŖ£ŗNH4++OH- $\frac{\underline{\;\;”÷\;\;}}{\;}$NH3”ü+H2O£»
¢ŚDĪŖNH3£¬Čō2.24LµÄD±»50mL 1mol/LĮņĖįĪüŹÕ£¬Ōņ·“Ӧɜ³É£ØNH4£©2SO4£¬ĪŖĒæĖįČõ¼īŃĪ£¬Ė®½ā³ŹĖįŠŌ£¬Ąė×ÓÅØ¶Č“óŠ”Ė³ŠņĪŖc£ØNH4+£©£¾c£ØSO42-£©£¾c£ØH+£©£¾c£ØOH-£©£¬
¹Ź“š°øĪŖ£ŗc£ØNH4+£©£¾c£ØSO42-£©£¾c£ØH+£©£¾c£ØOH-£©£»
£Ø2£©¢Ł2CH3OH£Øl£©+3O2£Øg£©=2CO2£Øg£©+4H2O£Øg£©”÷H=-a kJ•mol-1
¢Ś2CO£Øg£©+O2£Øg£©=2CO2£Øg£©”÷H=-b kJ•mol-1
¢ŪH2O£Øg£©=H2O£Øl£©”÷H=-c kJ•mol-1
½įŗĻøĒĖ¹¶ØĀɼĘĖć£¬£Ø¢Ł-¢Ś+4”Į¢Ū£©”Į$\frac{1}{2}$µĆµ½CH3OH£Øl£©+O2£Øg£©=CO£Øg£©+2H2O£Øl£©”÷H=$\frac{b-a-4c}{2}$KJ/mol£¬
¹Ź“š°øĪŖ£ŗ$\frac{b-a-4c}{2}$£»
£Ø3£©ŌŚ½ųŠŠ³Įµķ·“Ó¦µÄŹµŃ鏱£¬ĻņÉĻ²ćÉĻĒåŅŗµĪ¼ÓČÜŅŗ£¬µĪ¼ÓŹŌ¼ĮČō²»ŌŁÉś³É³Įµķ£¬ŌņČĻ¶Ø³ĮµķŅŃ¾ĶźČ«£¬ŌŚ¹żĀĖĘ÷ÉĻĻ“µÓ³ĮµķµÄ²Ł×÷ŹĒŃŲ×Ų£Į§°ōĻņ¹żĀĖĘ÷×¢ČėÕōĮóĖ®½žĆ»³Įµķ£¬Ė®×ŌČ»Į÷ĻĀ£¬ÖŲø“2”«3“Ī£¬
¹Ź“š°øĪŖ£ŗĻņÉĻ²ćĒåŅŗÖŠ£Ø»ņȔɣĮæÉĻ²ćĒåŅŗ·ÅČėŠ”ŹŌ¹ÜÖŠ£©µĪ¼Ó³Įµķ¼Į£¬Čē¹ū²»ŌŁ²śÉś³Įµķ£¬ĖµĆ÷³ĮµķŅŃ¾Ķź³É£»Ļņ¹żĀĖĘ÷ÖŠ¼ÓČėÕōĮóĖ®£¬Ö±ÖĮĖ®ĆęĶźČ«½žĆ»³ĮµķĪļ£¬µČĖ®×ŌČ»Į÷Ķźŗó£¬ÖŲø“²Ł×÷2µ½3“Ī£»
£Ø4£©ĮņĖįĢśæÉ×÷ŠõÄż¼Į£¬³£ÓĆÓŚ¾»Ė®£¬ĘäŌĄķŹĒFe3++3H2O?Fe£ØOH£©3+3H+£¬Éś³É½ŗĢ壬¾ßÓŠĪüø½ŠŌ£¬æɾ»»ÆĖ®£»¶ųĖįŠŌĢõ¼žŅÖÖĘĮĖĢśĄė×ÓµÄĖ®½ā£¬ĪŽ·ØÉś³ÉĒāŃõ»ÆĢś½ŗĢ壬²»ÄÜŹ¹Šüø”Īļ³Į½µ³żČ„£¬
¹Ź“š°øĪŖ£ŗFe3++3H2OØTFe£ØOH£©3£Ø½ŗĢ壩+3H+£»ĖįŠŌ½ĻĒæČÜŅŗÖŠH+ŅÖÖĘFe3+Ė®½ā£¬µĆ²»µ½Fe£ØOH£©3½ŗĢ壬¹Ź²»Äܾ»Ė®£®
µćĘĄ ±¾Ģāæ¼²éĪŽ»śĪļµÄĶʶĻ”¢ŹµŃ黳±¾²Ł×÷£¬²ąÖŲÓŚæ¼²éĄė×Ó·“Ó¦·½³ĢŹ½µÄŹéŠ“£¬ŹģĻ¤·¢ÉśµÄ·“Ó¦¼“æɽā“š£¬×¢ŅāĢāÄæÖŠµÄŠÅĻ¢ŗĶĖłŃ§ÖŖŹ¶µÄ½įŗĻĄ“ÅŠ¶ĻĪļÖŹ¼°ÅØ¶ČµÄ¼ĘĖćµČĄ“½ā“š£¬ĢāÄæÄѶČÖŠµČ£®


 Ó„ÅɽĢøØĻĪ½Ó½Ģ²ÄŗÓ±±½ĢÓż³ö°ęÉēĻµĮŠ“š°ø
Ó„ÅɽĢøØĻĪ½Ó½Ģ²ÄŗÓ±±½ĢÓż³ö°ęÉēĻµĮŠ“š°ø ³õÖŠŹīĘŚĻĪ½ÓĻµĮŠ“š°ø
³õÖŠŹīĘŚĻĪ½ÓĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 1molČéĖį£Ø £©ÄÜÓė1mol NaĶźČ«·“Ó¦ £©ÄÜÓė1mol NaĶźČ«·“Ó¦ | |
| B£® | Ņ»ĀČ¼×Ķé£ØCH3Cl£©ŗĶ¶žĀČŅŅĶé£ØClCH2CH2Cl£©ŹĒĶ¬ĻµĪļ | |
| C£® | ¶”ĶéÓŠ2ÖÖĶ¬·ÖŅģ¹¹Ģ壬Ņņ“Ė¶”“¼Ņ²ÓŠĮ½ÖÖĶ¬·ÖŅģ¹¹Ģå | |
| D£® | ±ūĻ©ÄÜŹ¹äåĖ®ĶŹÉ«£¬±ūĻ©·Ö×ÓÖŠ×ī¶ąÓŠ7øöŌ×ÓĪ»ÓŚĶ¬Ņ»Ę½ĆęÄŚ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
 Ļņŗ¬ÓŠ0.5mol HClŗĶ0.5mol MgSO4µÄ»ģŗĻČÜŅŗÖŠÖš²½¼ÓČė1mol•L-1µÄBa£ØOH£©2ČÜŅŗ£®ĒėĶعż¼ĘĖć²¢ŅŌׯ×ų±źĪŖ³ĮµķĪļÖŹµÄĮ棬ŗį×ų±źĪŖĖł¼ÓBa£ØOH£©2ČÜŅŗµÄĢå»ż×÷Ķ¼£®
Ļņŗ¬ÓŠ0.5mol HClŗĶ0.5mol MgSO4µÄ»ģŗĻČÜŅŗÖŠÖš²½¼ÓČė1mol•L-1µÄBa£ØOH£©2ČÜŅŗ£®ĒėĶعż¼ĘĖć²¢ŅŌׯ×ų±źĪŖ³ĮµķĪļÖŹµÄĮ棬ŗį×ų±źĪŖĖł¼ÓBa£ØOH£©2ČÜŅŗµÄĢå»ż×÷Ķ¼£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 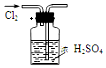 øÉŌļCl2 | B£® |  ĪüŹÕHCl | ||
| C£® |  ÓĆ×ŌĄ“Ė®ÖĘÕōĮóĖ® | D£® |  ĪüŹÕNH3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | C+O2 $\frac{\underline{\;\;”÷\;\;}}{\;}$CO2 | B£® | HCl+NaOH=NaCl+H2O | ||
| C£® | 2KClO3$\frac{\underline{\;\;”÷\;\;}}{\;}$2KCl+3O2”ü | D£® | Zn+2HCl=ZnCl2+H2”ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĖüĆĒµÄ·Ö×ÓŹżÄæÖ®±ČĪŖ1£ŗ1 | B£® | ĖüĆĒĖłŗ¬ŃõŌ×ÓŹżÄæÖ®±ČĪŖ2£ŗ3 | ||
| C£® | ĖüĆĒĖłŗ¬Ō×ÓŹżÄæÖ®±ČĪŖ3£ŗ4 | D£® | ĖüĆĒµÄÖŹĮæÖ®±ČĪŖ1£ŗ1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “ÖĶµē½ā¾«Į¶Ź±£¬µē½āÖŹČÜŅŗµÄ×é³ÉŗĶÅØ¶Č¾ł±£³Ö²»±ä | |
| B£® | ĢśÖĘĘ·ÉĻ¶ĘŅ»¶Øŗń¶ČµÄŠæ²ć£¬Ń”ÓĆŠæ×÷Ńō¼«£¬¶Ę¼ž×÷Ņõ¼«£¬ŗ¬ŠæĄė×ÓµÄČÜŅŗ×÷µē½āŅŗ | |
| C£® | µē½āĀČ»ÆÄĘČÜŅŗæÉŅŌÖʱø½šŹōÄĘ | |
| D£® | ĀČ¼ī¹¤ŅµÖŠ£¬µē½ā±„ŗĶŹ³ŃĪĖ®Ź±£¬Ńō¼«ÉĻ²śÉśCl2ŗĶNaOH |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŠĀÖĘĀČĖ® | B£® | ĘÆ°×·ŪµÄĖ®ČÜŅŗ | C£® | “ĪĀČĖįÄĘČÜŅŗ | D£® | ¶žŃõ»ÆĮņ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com