
【题目】进行化学实验时应强化安全意识。下列做法正确的是( )
A.汽油着火时,应该用水浇灭
B.用试管加热碳酸氢钠固体时使试管口竖直向上
C.浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗
D.实验室制取蒸馏水时应向蒸馏烧瓶中加入碎瓷片
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】已知某水溶液中大量存在H+、Mg2+、K+、NO3﹣、Cl﹣中的四种离子,且存在的各离子具有相同的物质的量,则不能存在的离子是( )
A.H+
B.Mg2+
C.Cl﹣
D.NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H—离子可以跟NH3反应:H— + NH3 = NH2— + H2,根据该反应事实,正确结论是
A. NH3具有还原性 B. H—是很强的氧化剂
C. H2既是氧化产物又是还原产物 D. 该反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示有机化合物的性质说法不正确的是( ) 
A.既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B.1 mol 该化合物最多可以与3 mol NaOH反应
C.既能催化加氢,又能使酸性KMnO4溶液褪色
D.既能与FeCl3溶液发生显色反应,又能与NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁、铝的混合物共0.2mol,溶于200mL 4mol·L﹣1的盐酸溶液中,然后再滴加2mol·L﹣1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m 随加入NaOH溶液的体积V变化情况如图所示.当V1=160mL时,则金属粉末中n(Al)=___________mol
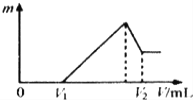
(2)0~V1段发生的反应的离子方程式为_____________________________。
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=_____________mL。
(4)沉淀质量m 减小的阶段,反应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列各问:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有 性.
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 (填序号)。
① Cu + HNO3(浓)→ Cu(NO3)2
② Cu + HNO3(稀)→ Cu(NO3)2
③ Cu![]() CuO
CuO ![]() Cu(NO3)2
Cu(NO3)2
(3)①在50mL 18mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是 。
A.20.16L B.6.72L C.10.08L D.15.12L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式 。
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 氯水的颜色呈浅黄绿色,说明氯水中含有![]()
B. 干燥氯气与湿润氯气漂白性的对比实验证明,氯水中具有漂白性的微粒是![]()
C. 向氯水中加入![]() 粉末,有气泡产生,说明氯水中含有
粉末,有气泡产生,说明氯水中含有![]()
D. 向![]() 溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有
溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是( )
A. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O==HClO+HSO3-
B. 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合: Al3++2SO42-+2Ba2++4OH- =2BaSO4+AlO2-+ 2H2O
C. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() + 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
D. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H+ +2I-=2Fe2+ +I2 +3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:
该元素核外价电子排布图 , 该元素基态原子结构示意图 . 该元素的名称为 , 形成的单质为晶体.
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:、、 .
(3)试比较下列含氧酸的酸性强弱:H3PO4H3PO3(填“>”、“<”或“=”).
(4)根据价层电子对互斥理论判断:NH3的电子式为中心原子的杂化方式为
杂化,VSEPR构型为 , 分子的立体构型为 .
(5)在下列物质①CO2、②NH3、③CCl4、④C2H2、⑤H2O、⑥SO2、⑦SO3、⑧、PCl3中,属于非极性分子的是(填序号).
(6)H2O的沸点(100℃)比H2S的沸点(﹣61℃)高,这是由于 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com