
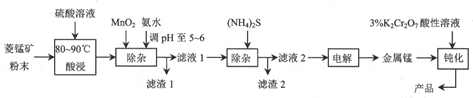
分析 向碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)中加入硫酸,可以发生反应生成硫酸盐,向其中就如具有氧化性的二氧化锰,可以将亚铁离子氧化为铁离子,调节pH可以将氢氧化铁沉淀下来,向滤液中加入硫化铵,可以将镍离子、钴离子形成硫化物沉淀下来,最后对得到的含有锰离子的盐电解,可以得到金属锰,
(1)温度控制是为了获得较大的反应速率,同时避免反应①逆向进行有效锰的浸出率;
(2)据得失电子守恒有MnO2+2Fe2+--Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+--Mn2++2Fe3+,最后据原子守恒得MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(3)由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
(4)由于第二次过滤后的滤液中主要含有NiSO4,电解该溶液时Ni2+在阴极上被还原:Mn2++2e-=Mn,阴极上会产生少量气体是溶液中氢离子得到电子生成氢气;
(5)用3%的K2Cr2O7酸性溶液钝化处理,还原产物为Cr3+,假定钝化层的化学成分为MnOx,发生的反应是重铬酸钾氧化锰离子生成MnOx,结合电荷守恒和原子守恒配平书写离子方程式.
解答 解:(1)酸浸时控制温度为80~90℃,原因是温度过低反应速率小,温度过高反应①平衡逆向移动,锰元素的浸出率降低,
故答案为:温度过低反应速率小,温度过高反应①平衡逆向移动,锰元素的浸出率降低;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式是据得失电子守恒有MnO2+2Fe2+-Mn2++2Fe3+,再据电荷守恒有MnO2+2Fe2++4H+-Mn2++2Fe3+,最后据原子守恒得,MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,再加入氨水调节pH至5~6的作用是沉淀铁离子生成氢氧化铁沉淀,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;使Fe3+转化为Fe(OH)3沉淀;
(3)由于在第一次过滤之后的滤液中含有Mn2+、Ni2+、Co2+,向其中加入(NH4)2S,根据各物质的溶度积常数可确定有CoS和NiS沉淀(滤渣2)生成;
故答案为:CoS和NiS;
(4)由于第二次过滤后的滤液中主要含有NiSO4,电解该溶液时Ni2+在阴极上被还原:Mn2++2e-=Mn,阴极上溶液中的氢离子得到电子生成氢气,
故答案为:Mn2++2e-=Mn;H2;
(5)用3%的K2Cr2O7酸性溶液钝化处理,还原产物为Cr3+,假定钝化层的化学成分为MnOx,发生的反应是重铬酸钾氧化锰离子生成MnOx,结合电荷守恒和原子守恒配平书写离子方程式为:xCr2O72-+3Mn2++8xH+=2xCr3++3MnOx+4xH2O,
故答案为:xCr2O72-+3Mn2++8xH+=2xCr3++3MnOx+4xH2O.
点评 本题考查了物质分离提纯的过程分析,主要是物质性质、反应条件、产物判断、除杂实验方法等知识点,题目难度中等.


科目:高中化学 来源: 题型:选择题
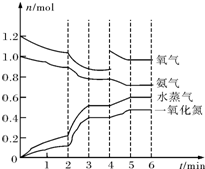 在一密闭容器中,高温下发生下述反应(不考虑NO与氧气的反应):4NH3(g)+5O2(g)?4NO(g)+6H2O(g).容器中NH3、O2、NO、H2O四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.反应进行至2min时,只改变了某一条件,使曲线发生变化,该条件可能是下述中的( )
在一密闭容器中,高温下发生下述反应(不考虑NO与氧气的反应):4NH3(g)+5O2(g)?4NO(g)+6H2O(g).容器中NH3、O2、NO、H2O四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示.反应进行至2min时,只改变了某一条件,使曲线发生变化,该条件可能是下述中的( )| A. | 充入了O2(g) | B. | 降低温度 | C. | 加了催化剂 | D. | 扩大了容器体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质A一定是乙醛 | |
| B. | 物质B的分子式为C4H8O2 | |
| C. | 物质B的同分异构体中既含有醛基又含有羟基的共有6种 | |
| D. | 物质A和物质B互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 安装燃煤“固硫”装置,可以降低酸雨发生率 | |
| B. | 氮的固定只有在高温、高压、催化剂的条件下才能实现 | |
| C. | 研发易降解塑料,防止白色污染 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活性炭与新制氯水的漂白原理相同 | |
| B. | 过氧化钠常用于羽绒制品的漂白 | |
| C. | 漂白粉是由Ca(ClO)2组成的纯净物 | |
| D. | 将漂白剂SO2和NaClO混合使用可增加漂白效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>X,离子半径:Z<W | |
| B. | 元素Y的单质能与元素X的最高价氧化物发生置换反应 | |
| C. | 元素Y和W能形成YW2型共价化合物 | |
| D. | W的单质有毒,且有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学键的断裂过程中,肯定发生了化学反应 | |
| B. | 发生能量变化的一定是化学反应 | |
| C. | 离子化合物中一定含有离子键,共价化合物中一定不含离子键 | |
| D. | 在化学键的断裂过程中,肯定放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L Cl2通入足量水中或NaOH溶液中,转移的电子数均为0.1NA. | |
| B. | 1mol CnH2n含有的共用电子对数为(3n+1)NA | |
| C. | 电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子书为0.2NA | |
| D. | 2gD2160中含中子、质子、电子数目均为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com