
| A. | 2 mol/L NaOH的溶液 | B. | 2 mol/L Na2SO4的溶液 | ||
| C. | 2 mol/L MgSO4的溶液 | D. | FeCl3溶液 |
分析 氢氧化铝胶体中加入可溶性电解质能够使胶体发生聚沉,氢氧化铝为两性氢氧化物,既能够与强酸反应,又能够与强碱反应,据此解答.
解答 解:氢氧化铝胶体中加入可溶性电解质能够使胶体发生聚沉,氢氧化铝为两性氢氧化物,既能够与强酸反应,又能够与强碱反应,
A.氢氧化钠为可溶性强电解质,能够使氢氧化铝胶体聚沉而产生沉淀,氢氧化铝与氢氧化钠反应生成可溶性偏铝酸盐,所以先产生沉淀,后沉淀溶解,故A正确;
B.硫酸钠为可溶性电解质,能够使氢氧化铝胶体聚沉产生沉淀,但是氢氧化铝不与硫酸钠反应,沉淀不溶解,故B错误;
C.硫酸镁为可溶性电解质,能够使氢氧化铝胶体聚沉产生沉淀,但是氢氧化铝不与硫酸镁反应,沉淀不溶解,故C错误;
D.氯化铁为可溶性电解质,能够使氢氧化铝胶体聚沉产生沉淀,但是氢氧化铝不与氯化铁反应,沉淀不溶解,故D错误;
故选:A.
点评 本题考查了元素化合物知识,熟悉胶体的性质、氢氧化铝的性质即可解答,题目不难.


科目:高中化学 来源: 题型:解答题
 3-甲基戊烷
3-甲基戊烷 2,2,3-三甲基丁烷
2,2,3-三甲基丁烷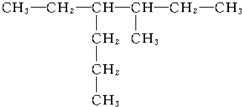 3-甲基-4-乙基庚烷
3-甲基-4-乙基庚烷 2,5-二甲基-3-乙基戊烷
2,5-二甲基-3-乙基戊烷 3,4-二甲基-5-乙基辛烷
3,4-二甲基-5-乙基辛烷 3-甲基-4-乙基己烷.
3-甲基-4-乙基己烷.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.0 | ≥6.7 | ≥3.2 |
| A. | 向该混合溶液中逐滴加入NaOH溶液,最先看到白色沉淀 | |
| B. | PH=10时溶液中c(Cu2+):c(Fe2+:c(Fe3+)=(2.2×10-20):(8.0×10-16 ):( 4.0×10-34 ) | |
| C. | 该溶液中2c(SO42-)=2c(Cu2+)+2c(Fe2+)+3c(Fe3+) | |
| D. | 通入氨气将该溶液的PH调节到9后所得沉淀经过过滤、洗涤、干燥、灼烧,可得三种金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/mL | 测得生成沉淀的质量/g |
| 1 | 0.858 | 500 | 1.379 |
| 2 | 1.716 | 500 | |
| 3 | 2.574 | 500 | 4.137 |
| 4 | 3.432 | 500 | 5.516 |
| 5 | 4.290 | 500 | 5.516 |
| 6 | 5.148 | 500 | 5.516 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
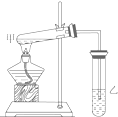 如图是某学生设计的制取乙酸乙酯的实验装置图,实验中采取了以下主要实验操作:
如图是某学生设计的制取乙酸乙酯的实验装置图,实验中采取了以下主要实验操作:查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com