
【题目】如图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是( )
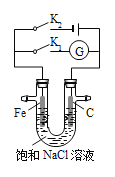
A.K1闭合,K2打开,铁棒上发生的反应为2Cl2e== Cl2↑
B.K1闭合,K2打开,石墨棒周围溶液pH逐渐减小
C.K1打开,K2闭合,铁棒不会被腐蚀,属于外加电流的阴极保护法
D.K1打开,K2闭合,电路中通过0.002 mol电子时,两极共产生0.001 mol气体
【答案】C
【解析】
根据装置图可知,当K1闭合K2打开时,该装置为原电池,发生的是铁的吸氧腐蚀;当K1打开K2闭合时,铁做阴极,碳做阳极,总反应为电解饱和食盐水:2NaCl+2H2O![]() H2↑+Cl2↑+2NaOH 。依此对各选项做出判断。
H2↑+Cl2↑+2NaOH 。依此对各选项做出判断。
A项、K1闭合K2打开时,该装置为原电池,铁棒为负极发生氧化反应:Fe-2e-=Fe2+,A选项错误;
B项、碳为正极发生还原反应:O2+2H2O+4e-=4OH-,所以B选项错误;
C项、K1打开、K2闭合时,该装置为电解池,铁棒接电源负极做阴极被保护,属于外加电流的阴极保护法,C选项正确;
D项、此时阴极发生还原反应:2H++2e-=H2↑,产生的气体为:0.002 mol÷2=0.001mol,碳棒接电源正极做阳极发生氧化反应:2Cl2e== Cl2↑,产生的气体为:0.002 mol÷2=0.001mol,两极共产生气体产生的气体为:0.001mol+0.001mol=0.002mol,D选项错误;
答案选C。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
A.砷原子的结构示意图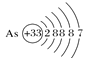 B.BF4—的结构式
B.BF4—的结构式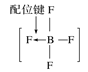
C.HF分子间的氢键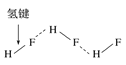 D.丙氨酸的手性异构
D.丙氨酸的手性异构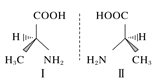
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌灰是炼锌厂的烟道灰,含ZnO 35%以上,还含有少量的氧化锰(MnO)、氧化铜、 铁的氧化物和不溶于酸的杂质,工业上常用酸浸法回收 ZnSO4·7H2O。已知 ZnSO4·7H2O 晶体易溶于水,难溶于酒精,某兴趣小组实验室模拟回收 ZnSO4·7H2O 晶体,流程如下:

请回答:
(1)分析步骤 II 中的操作和原理, 回答下列问题:
①结合表 1、 2,分析选择的 pH 及温度分别是______________________, 其中, 可以采用加入_________________________来调节 pH ;
表1 pH对ZnSO4.7H2O 回收量及纯度的影响
pH | ZnSO4.7H2O 回收量(g) | 产品中Fe的含量% | 产品中其他重金属含量% |
1 | 114.32 | 0.750 | 0.059 |
2 | 114.4 | 0.086 | 0.056 |
3 | 113.68 | 0.034 | 0.054 |
4 | 113.60 | 0.010 | 0.050 |
5 | 112.43 | 0.010 | 0.050 |
表2 温度对ZnSO4.7H2O 回收量及纯度的影响
温度 (℃) | ZnSO4.7H2O 回收量(g) | 产品中F的含量% | 产品中其他重金属含量% |
20 | 111.45 | 0.011 | 0.052 |
40 | 112.89 | 0.010 | 0.051 |
60 | 113.30 | 0.010 | 0.050 |
80 | 113.80 | 0.010 | 0.050 |
90 | 114.40 | 0.091 | 0.048 |
②酸性 KMnO4 溶液将溶液中的 Fe2+氧化,生成两种沉淀;同时,过量的高锰酸钾在微酸性的条件能自动分解生成MnO2 沉淀。试写出在该环境下,KMnO4 溶液氧化 Fe2+的离子反应方程式_________________________________________。 若用稀硝酸做氧化剂,除了产物中可能含有 Zn(NO3)2 外,还可能的缺点是:_________________________;
(2)分析整个实验过程中,回答下列问题:
①滤渣 B 的主要成分为___________________________;
②如何检验滤液B中是否含有铁元素_____________________________________;
③写出生成滤渣C的离子方程式__________________________________________;
(3)为测定 ZnSO4·7H2O 晶体的纯度,可用 K4Fe(CN)6 标准液进行滴定。主要原理如下:2K4Fe(CN)6+ 3ZnSO4= K2Zn3[Fe(CN)6]2↓+ 3K2SO4
准确称取 5.000g ZnSO4·7H2O 晶体,用蒸馏水溶解并定容至 250mL,准确移取该溶液 25.00mL至锥形瓶中,用 0.0500mol/L K4Fe(CN)6 溶液进行滴定,所得数据如下表:
实验次数 | 滴定前读数/mL | 滴定后读数/mL |
1 | 0.10 | 19.92 |
2 | 1.34 | 21.12 |
3 | 0.00 | 20.10 |
则 ZnSO4·7H2O 晶体的纯度是_______________(以质量分数表示,保留到小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3 mol A气体和1 mol B气体通入一容积固定为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)反应1 min时测得剩余1.8 mol A,C的浓度为0.4 mol/L,则1 min内,B的平均反应速率为___________;x为____________。
(2)若反应经2 min达到平衡,平衡时C的浓度______________0.8 mol/L(填“大于”、“小于”或“等于”)
(3)能加快反应速率的措施是____________。
①升高温度
②容器体积不变,充入惰性气体Ar
③容器压强不变,充入惰性气体Ar
④使用催化剂
⑤将容器体积缩小一半
(4)能够说明该反应达到平衡的标志是____________。
A.容器内混合气体的密度保持不变
B.容器内混合气体的压强保持不变
C.A、B的浓度之比为3:1
D.单位时间内断开3n mol A-A键的同时生成n mol B-B
E.v(A)=3v(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合溶液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示:
①3Fe+NaNO2+5NaOH===3Na2FeO2+H2O+NH3↑
②![]() Na2FeO2+
Na2FeO2+![]() NaNO2+
NaNO2+![]() H2O―→
H2O―→![]() Na2Fe2O4+
Na2Fe2O4+![]() NH3↑+
NH3↑+![]() NaOH
NaOH
③Na2FeO2+Na2Fe2O4+2H2O![]() Fe3O4+4NaOH
Fe3O4+4NaOH
请回答下列问题:
(1)配平化学方程式②,各物质前的化学计量数依次为_____________。
(2)上述反应①中氧化剂为______,被氧化的物质是______。若有2 mol Na2FeO2生成,则反应①中有________mol电子发生转移。
(3)关于“发蓝”的过程,下列说法不正确的是________(填字母)。
A.该过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当混合溶液中NaOH浓度过大,“发蓝”的厚度会变小,其原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化剂在生产和科技领域起到重大作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性如图甲可通过观察_____________,定性比较得出结论。同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论__________(填“合理”或“不合理”),理由是___________
(2)定量如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是_____________________。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
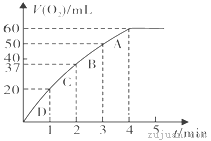
①实验时放出气体的总体积是__________mL。
②放出1/3气体所需时间为___________min。
③计算H2O2的初始物质的量浓度_______________。 (请保留两位有效数字)
④A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成的中间体,G的一种合成路线如下:
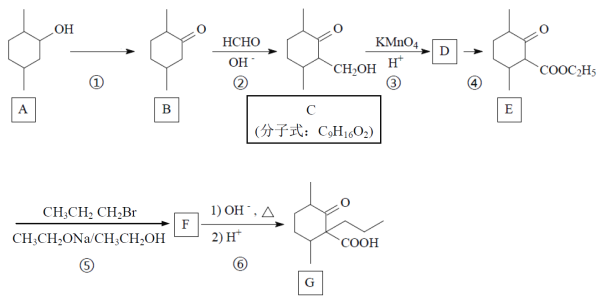
(1)写出A中官能团的电子式。_____________。
(2)写出反应类型:B→C___________反应,C→D__________反应。
(3) A→B所需反应试剂和反应条件为_______________________________。
(4) 写出C的符合下列条件同分异构体的结构简式:_________________________。(任写出3种)
①能水解;②能发生银镜反应;③六元环结构,且环上只有一个碳原子连有取代基。
(5)写出F的结构简式_______________________。
(6)利用学过的知识,写出由甲苯(![]() )和
)和![]() 为原料制备
为原料制备 的合成路线。(无机试剂任用)_____________________。
的合成路线。(无机试剂任用)_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com