
一定量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量石灰水吸收,可得100 g CaCO3沉淀,则完全燃烧46 g无水乙醇时放出的热量为( )
A.0.5Q B.Q C.2Q D.5Q
C
通过产生的100 g沉淀,确定出二氧化碳的质量,再通过二氧化碳的质量,确定燃烧的乙醇质量即确定出放出热量为Q时,燃烧的乙醇质量。通过比例关系可以确定燃烧46 g无水乙醇放出的热量。
乙醇燃烧的化学方程式和二氧化碳与石灰水反应的化学方程式如下:
C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
Ca(OH)2+CO2![]() CaCO3↓+H2O
CaCO3↓+H2O
乙醇完全燃烧后生成的二氧化碳与石灰水反应得到的沉淀,其关系式为:
C2H5OH—2CO2—2CaCO3
根据相对分子质量可知,46 g乙醇与200 g CaCO3是对应关系。产生100 g CaCO3沉淀时乙醇燃烧放出热量为Q,则产生200 g CaCO3沉淀时乙醇燃烧放出热量为2Q。


 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:阅读理解
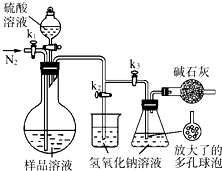 (2013?江苏三模)碳酸钠-过氧化氢加合物(aNa2CO3?bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
(2013?江苏三模)碳酸钠-过氧化氢加合物(aNa2CO3?bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
 【实验化学】
【实验化学】查看答案和解析>>
科目:高中化学 来源:全优设计必修二化学人教版 人教版 题型:013
|
一定量的无水乙醇完全燃烧时放出的热量为Q,它所生成的CO2用过量石灰水吸收,可得100 g CaCO3沉淀,则完全燃烧46 g无水乙醇时放出的热量为 | |
| [ ] | |
A. |
0.5Q |
B. |
Q |
C. |
2Q |
D. |
5Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com