
【题目】在卢瑟福粒子散射实验中,有少数粒子发生大角度偏转,其原因是
A. 原子中存在着带负电的电子
B. 正电荷在原子中是均匀分布的
C. 原子只能处于一系列不连续的能量状态中
D. 原子的正电荷和绝大部分质量都集中在一个很小的核里
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数, 下列说法正确的是( )
A.18g 水所含有的电子数目为NA
B.2g 氢气所含原子数为NA
C.过氧化钠与水反应生成标况下11.2L氧气电子转移的数目为NA
D.200 mL0.5mol/LNa2SO4溶液所含Na+数目0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物应用非常广泛,刻制印刷电路板时要用FeCl3溶液为腐蚀液,其反应的化学方程式为:2FeCl3+Cu =2FeCl2+CuCl2
⑴该反应的氧化剂是_______________________(填化学式)。
⑵请用双线桥法标出该反应电子的转移的方向和数目。2FeCl3+Cu =2FeCl2+CuCl2_____________________
⑶使用过的腐蚀液会失效,但还可以回收利用,其中有一步需要将Fe2+转化为Fe3+,下列试剂能实现上述变化的是_____________________________(填序号)。
①氯气 ②铁 ③盐酸 ④稀硫酸
⑷某久置的FeCl2溶液略显黄色,某同学认为可能有部分Fe2+被氧化为Fe3+,因此配制FeCl2溶液时需加少量铁粉,请写出Fe3+转化为Fe2+的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
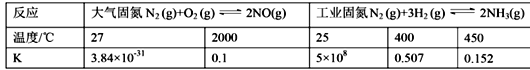
①分析数据可知:大气固氮反应属于 _______(填“吸热”或“放热”)反应。
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因 _____________________________________________。
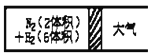
③在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。达到平衡时N2的转化率_______________________。
2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。达到平衡时N2的转化率_______________________。
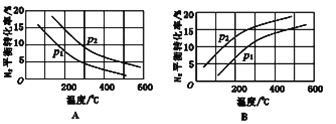
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,下图所示的图示中,正确的是_______(填“A”或“B”);比较p1、p2的大小关系: p1_______________p2(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)、(3)、(4)图中分别有OA﹕AB=2﹕3, OA=AB, OA﹕AB=3﹕2,则下列分析与判断不正确的是(忽略CO2的溶解)( )

A. M中只有一种溶质的有(1)和(3)
B. M中有两种溶质的有(2)和(4)
C. (2)图显示M中的溶质为NaHCO3和Na2CO3,二者的物质的量之比为2:1
D. (4)图显示M中的溶质为NaOH和Na2CO3,二者的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列问题:
K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(1)以上元素的基态原子的电子排布中,4s轨道上只有1个电子的元素有______(填元素名称)。
(2)以上元素中,属于s区的元素有_____种,属于d区的元素有______种。
(3)第一电离能I1(Cr)________I1(Co)(填“>”、“<”或“=”,下同)。
(4)现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() 。试推断紫色晶体的化学式为_________。
。试推断紫色晶体的化学式为_________。
(5)含有元素K的盐的焰色反应为__________色。许多金属盐都可以发生焰色反应,其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成具有良好生物降解性的有机高分子材料是有机化学研究的重要课题之一。聚醋酸乙烯酯(PVAc)水解生成的聚乙烯醇(PVA),具有良好生物降解性,常用于生产安全玻璃夹层材料PVB。有关合成路线如图(部分反应条件和产物略去)。
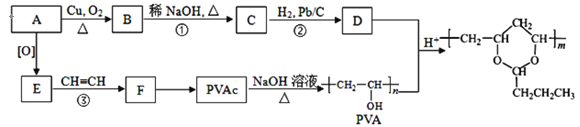
已知:Ⅰ.RCHO+R’CH2CHO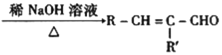 +H2O
+H2O
Ⅱ.![]() (R、R′可表示烃基或氢原子)
(R、R′可表示烃基或氢原子)
Ⅲ.A为饱和一元醇,其氧的质量分数约为34.8%,请回答:
(1)C中官能团的名称为_____,该分子中最多有_____个原子共平面。
(2)D与苯甲醛反应的化学方程式为_____。
(3)③的反应类型是____。
(4)PVAc的结构简式为____。
(5)写出与F具有相同官能团的同分异构体的结构简式____(任写一种)。
(6)参照上述信息,设计合成路线以溴乙烷为原料(其他无机试剂任选)合成 。____。
。____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )
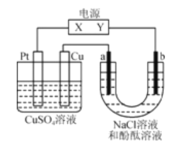
A. X极是电源负极,Y极是电源正极
B. a极的电极反应式为2Cl--2e-=Cl2
C. 电解过程中CuSO4溶液的pH逐渐增大
D. Cu电极上增重6.4g时,b极产生4.48L(标准状况)气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com