
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
| 27g |
| 108g/mol |
| ||
| 0.25mol |
| 25L |
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:
| 氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 3.7 | 9.7 | 6.7 |
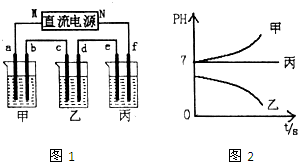
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
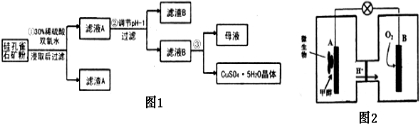
科目:高中化学 来源: 题型:
A、Cu
| ||||||
B、Cu
| ||||||
C、Cu
| ||||||
D、Cu
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在涂料中尽量用液态有机物代替水作溶剂以减少环境污染 |
| B、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 |
| C、石油分馏可获得乙烯、丙烯和丁二烯 |
| D、新型无机非金属材料Si3N4、Al2O3可以用于制作高温结构陶瓷制品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、引起空气发生化学变化 |
| B、产生杀菌消毒作用 |
| C、诱发动植物的基因突变 |
| D、造成病毒感染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/mL | 100 | 200 | 300 | 400 |
| 剩余金属/g | 18.0 | 9.6 | 0 | 0 |
| NO体积/mL | 2240 | 4480 | 6720 | V |
| A、实验①中硝酸只和铁粉反应 |
| B、原混合物总质量为105.6g |
| C、硝酸浓度为4mol?L-1 |
| D、V=6720 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/s | 0 | 500 | 1000 |
| C(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
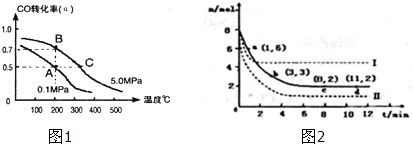
| 实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com