
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 强碱性溶液中可能大量存在Na+、K+、Cl?、CO32? | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42? |
分析 A.铝离子与硫离子发生双水解反应;
B.次氯酸根离子能够氧化碘离子,次氯酸根离子与酸性溶液中的氢离子反应生成次氯酸;
C.四种离子之间不反应,都不与强碱性溶液中的氢氧根离子反应;
D.铁离子只能存在于酸性溶液中.
解答 解:A.Al3+、S2之间发生双水解反应生成硫化氢气体和氢氧化铝沉淀,在溶液中不能大量共存,故A错误;
B.酸性溶液中存在大量氢离子,ClO?与H+、I?之间发生反应,在溶液中不能大量共存,故B错误;
C.碱性溶液中存在大量氢氧根离子,Na+、K+、Cl?、CO32?之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.Fe3+只能存在于酸性溶液,在中性溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| B. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量为0.5 mol的MgCl2中,含有Mg2+个数为 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密度比4:11 | B. | 分子数之比为4:11 | ||
| C. | 体积比4:11 | D. | 物质的量之比为4:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在紫外线、饱和(NH4)2SO4溶液、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性 | |
| B. | 用新制Cu(OH)2悬浊液可鉴别麦芽糖和蔗糖 | |
| C. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,震荡,若有油滴浮在液面上,说明油脂已完全反应 | |
| D. | CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作设计 | 现象记录 | 结论解释 |
| A | 将少量浓硝酸逐滴加入Cu和稀硫酸的混合物中 | 产生红棕色气体 | 硝酸被还原为NO2 |
| B | 用坩埚钳夹住铝箔在酒精灯上加热 | 铝箔熔化但并不滴落 | 熔点:Al2O3>Al |
| C | 向某氯化亚铁溶液中加入 Na2O2粉末 | 出现红褐色沉淀 | 加入Na2O2粉末前,原氯化亚铁溶液已经变质 |
| D | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 产生大量的白色沉淀 | Al(OH)3难溶于水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
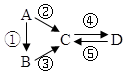
| A. | 若A是大气中含量最多的气体,C、D是氧化物且会造成光化学污染.则D转化成C的反应化学方程为3NO2+H2O=2HNO3+2NO | |
| B. | 若A、B、C分别为C(s)、CO(g)和CO2(g),且通过与O2(g)反应实现图示的转化.在同温同压且消耗含碳物质均为1mol时,反应①、②、③的焓变依次为△H1、△H 2、△H 3,则它们之间的关系为△H 2=△H1+△H 3 | |
| C. | 若C为一元强碱且阴、阳离子所含的电子数相同,D为日常生活中常用的调味品,工业上用D制备A的化学方程式2Na2O(熔融)$\frac{\underline{\;通电\;}}{\;}$4Na+O2↑ | |
| D. | 若A是应用最广泛的金属.④反应用到A,②、⑤反应均用到同一种气态非金属单质实验室保存D溶液的方法是加入适量铁粉与适量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
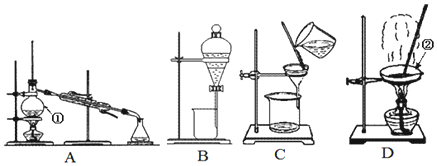
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com