
| A. | 原电池将化学能转变为电能 | |
| B. | 原电池将电能转变为化学能 | |
| C. | 中和反应放热说明中和反应前后能量不守恒 | |
| D. | 吸热反应中生成物的总能量低于反应物的总能量 |
分析 A.原电池是把化学能转变为电能的装置;
B.原电池是把化学能转变为电能的装置;
C.中和反应遵循能量守恒;
D.当反应物总能量大于生成物总能量时,反应放热,反之吸热.
解答 解:A.原电池是把化学能转变为电能的装置,将化学能转变为电能,故A正确;
B.原电池是把化学能转变为电能的装置,将化学能转变为电能,故B错误;
C.中和反应遵循能量守恒,为化学能转化为热能,故C错误;
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热,当反应物总能量大于生成物总能量时,反应放热,反之吸热,故D错误.
故选A.
点评 本题考查化学反应与能量变化,题目难度不大,注意相关基础知识的积累,注意相关概念的理解.


 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
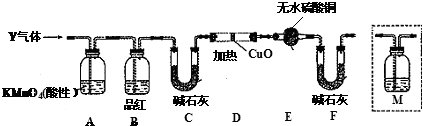
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中.| 滴定次数 | 待测液体积(mL) | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
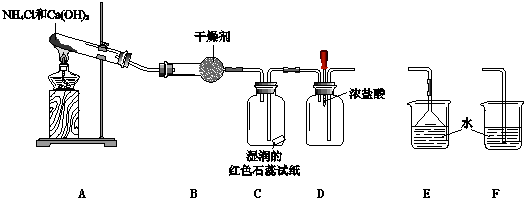
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算所需浓硫酸的体积 | 需取浓硫酸(1.7)mL |
| (2)量 取浓硫酸 | 需要用到的主要仪器是:5mL量筒 |
| (3)将 浓硫酸沿着玻璃棒缓缓注入盛有水的烧杯中并搅拌 | 该操作要做到胆大心细,杜绝事故发生 |
| (4)待溶液冷却至室温,将烧杯中溶液转移至250mL容量瓶中 | 要注意把洗涤液一并转移至容量瓶中 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2cm处后的正确操作是:改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切 |
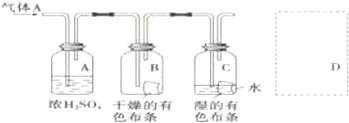
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | v(B2)=1.2mol/(L•s) | B. | v(A2)=0.4 mol/(L•s) | C. | v(C)=0.6 mol/(L•s) | D. | v(B2)=0.8 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com