
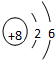 ;Z的电子式是
;Z的电子式是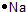 .
.分析 X、Y和Z均为短周期元素,原子序数依次增大.X原子的单质是密度最小的气体,则X为H;Y原子的最外层电子数是其周期数的3倍,Y原子只能有2个电子层,最外层电子数为6,则Y为O;Z与X原子最外层电子数相同,原子序数大于氧,则Z是钠,据此答题.
解答 解:X、Y和Z均为短周期元素,原子序数依次增大.X原子的单质是密度最小的气体,则X为H;Y原子的最外层电子数是其周期数的3倍,Y原子只能有2个电子层,最外层电子数为6,则Y为O;Z与X原子最外层电子数相同,原子序数大于氧,则Z是钠.
(1)X元素符号为H;Y为O元素,原子结构示意图是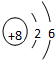 ,Z为Na,电子式是
,Z为Na,电子式是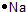 ,
,
故答案为:H;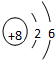 ;
; ;
;
(2)由H、O、Na元素组成的化合物中,既含有共价键又含有离子键的有NaOH、Na2O2,
故答案为:NaOH;Na2O2;
(3)H和O组成的化合物中,既含有极性共价键又含有非极性共价键的是H2O2.此化合物在酸性条件下与高锰酸钾反应的离子方程式为5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑;此化合物还可将碱性工业废水中的CN-氧化为碳酸根离子和氨气,相应的离子方程式为:H2O2+CN-+OH-═CO32-+NH3 ↑,
故答案为:H2O2;5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑;H2O2+CN-+OH-═CO32-+NH3 ↑.
点评 本题考查位置结构性质关系应用,关键是根据原子结构来推断元素,侧重对化学用语的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
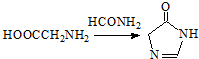
 .
.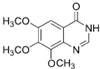 .
.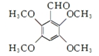 .
.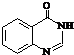 .合成过程中无机试剂任选.
.合成过程中无机试剂任选.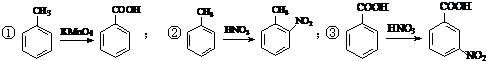 )
)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
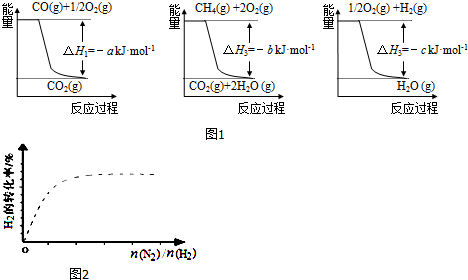
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 |
| 达到平衡的时间(min) | t | 5 |
| 平衡时N2的浓度(mol•L-1) | 3 | c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 为不稳定结构.
为不稳定结构. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将amol/L的Na2RO3溶液与bmol/L的NaHRO3溶液等体积混合后,若c(Na+)>c(HRO3-)>c(RO32-)>c(OH-)>c(H+),则a<b | |
| B. | 0.1mol•L-1NH4HS溶液中:c(NH4+)=c(HS-)+c(S2-)+c(H2S) | |
| C. | 若KHA溶液呈弱酸性,则c(K+)>c(A2-)>c(HA-)>c(H+)>c(OH-) | |
| D. | 向AgNO3溶液中逐滴滴加等物质的量浓度的KCl和K2CrO4的混合溶液,若先产生白色沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 |  CuSO4溶液 | 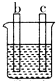 稀硫酸 | 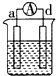 稀硫酸 |
| 现象 | a极质量减小 b极质量增大 | b极有气泡 c极无明显现象 | 电流从a极流向d极 |
| A. | d>a>b>c | B. | b>c>d>a | C. | a>b>c>d | D. | a>b>d>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com