
下列过程或现象与盐类水解无关的是 ( )
A.纯碱溶液去油污 B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭味
科目:高中化学 来源: 题型:
一定条件下,下列说法正确的是( )
A.常温下,pH相等的NaOH溶液和CH3COONa溶液中由水电离产生的c(OH-)相等
B.由水电离的c(H+)=1×10-11 mol·L-1的溶液一定是碱性溶液
C.两种难溶性盐,Ksp较小的,其溶解度也一定较小
D.Na2CO3溶液和NaHCO3溶液中一定都存在:
2c(CO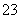 )+c(OH-)+c(HCO
)+c(OH-)+c(HCO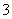 )=c(H+)+c(Na+)
)=c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子中,各分子的空间构型和中心原子的杂化方式均正确的是 ( )
A、NH3 平面三角形 sp3杂化 B、CCl4 正四面体 sp3杂化
C、H2O V形 sp2杂化 D、CO32- 三角锥形 sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2(g)+3H2(g)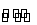 2NH3(g) ΔH<0,达到平衡后,为了使氢气的转化率增大,下列选项中采用的三种方法正确的是( )
2NH3(g) ΔH<0,达到平衡后,为了使氢气的转化率增大,下列选项中采用的三种方法正确的是( )
A.升高温度、降低压强、增加氮气
B.降低温度、增大压强、加入催化剂
C.升高温度、增大压强、增加氮气
D.降低温度、增大压强、分离出部分氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
在一容积为2 L的密闭容器中,加入0.2 mol N2和0.6 mol H2,在一定条件下发生反应:N2(g)+3H2(g)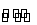 2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中 NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
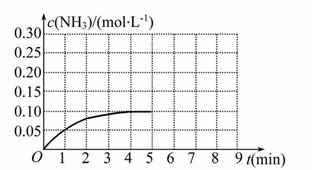
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N H3)为_________。
H3)为_________。
(2)该反应达到平衡时H2的转化率__ ______。
______。
(3)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为___________。(填序号)
A.0.20 mol·L-1 B.0.12 mol·L-1
C.0.10 mol·L-1 D.0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
(5)若该反应在298 K、398 K时的化学平衡常数分别为K1、K2,则K1______K2(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25 mL,物质的量浓度均为0.1 mol/L,下列说法正确的是( )
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25 mL 0.1 mol·L-1的盐酸后,pH最大的是①
D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
 (1)NH4Al(SO4)2可作净水剂,其原理是___________________________
(1)NH4Al(SO4)2可作净水剂,其原理是___________________________
_
(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2溶液中c(NH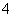 )________(填“等于”、“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中c(NH
)________(填“等于”、“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中c(NH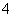 )。
)。
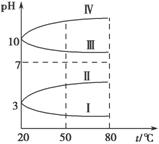
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填字母),导致pH随温度变化的原因是 ;
 ②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2c(SO
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2c(SO )-c(NH
)-c(NH )-3c(Al3+)=________。
)-3c(Al3+)=________。
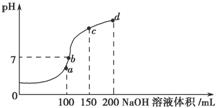
(4)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示.试分析图中a、b、c、d四个点,水的电离程度最大的是________点,在b点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的氧化铝膜。某研究性学习小组对铝表面氧化膜的保护作用展开了研究,他们查阅有关资料得知:尽管铝表面致密的氧化膜能使铝与其周围的介质(如空气、水等)隔绝,对铝制品起到保护作用,但铝制容器仍不能长期盛放或腌制咸菜。该小组同学设计了一个实验以探究其中的原因。他们的实验过程如下所示:
| 实验 | ||
| 编号 | 实验过程 | 实验现象 |
| 1 | 取一小片铝片于试管中,加入2 mL 1.0 mol·L-1盐酸 | 30 s时开始有少量气泡,然后产生气泡的速率逐渐加快,最后铝片消失 |
| 2 | 取一小片铝片于试管中,加入2 mL 0.5 mol·L-1硫酸 | 55 s时开始有少量气泡,然后产生气泡的速率逐渐加快,最后铝片消失 |
| 3 | 取一小片铝片于试管中,加入氯化铜稀溶液 | 3 min左右表面产生少量气泡,且铝表面析出一些红色固体 |
| 4 | 取一小片铝片于试管中,加入硫酸铜稀溶液 | 一直没有明显的变化 |
(1)你认为实验1、2中盐酸和硫酸的浓度分别为1.0 mol·L-1、0.5 mol·L-1的原因是__________________________________。
(2)根据该实验现象,你认为铝制容器不能长期盛放或腌制咸菜的原因是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法正确的是( )
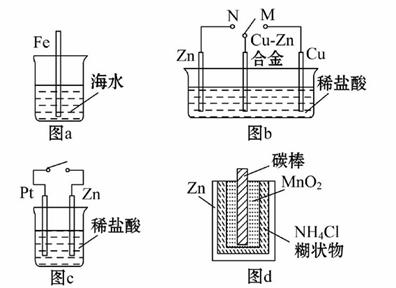
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时,Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池的放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com