
| ||
| 放电 |
| A、PbSO4的氧化性比PbO2的强、还原性比Pb的强 |
| B、放电时,PbO2为氧化剂、做负极,Pb为还原剂、做正极 |
| C、放电时,当有2mol H2SO4反应时,会有1.204×1024个电子从铅电极流出 |
| D、充电时,PbSO4既被氧化又被还原,Pb是阳极产物之一 |
| 2mol |
| 2 |


科目:高中化学 来源: 题型:
| A、含有大量[Al(OH)4]-的溶液中:Na+、OH-、Cl-、CO32- | ||
B、常温下
| ||
| C、能使pH试纸显红色的溶液中:Na+、ClO-、Fe2+、SO42- | ||
| D、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验现象 | 硫酸所表现的性质或特性 |
| 敞口放置浓硫酸时,质量增加 | |
| 锌粒放入稀硫酸中时,有气体放出 | |
| 把木屑放入浓硫酸中时,变黑 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 原因 | 结果 |
| A | 汽车尾气的大量排放 | 光化学烟雾 |
| B | SO2和NO2气体大量排放 | 酸雨 |
| C | 含氮、磷等生活废水的大量排放 | 水体富营养化 |
| D | 大量植树造林 | 温室效应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| B、实验室盛碱液的瓶子不用玻璃塞:SiO2+2OH-═SiO32-+H2O |
| C、用稀盐酸和大理石反应制取CO2:CO32-+2H+═CO2↑+H2O |
| D、向Ca(ClO)2溶液中通入过量CO2制取次氯酸:2ClO-+H2O+CO2═2HClO+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
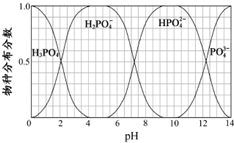 H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.下列有关说法不正确的是( )
H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示.下列有关说法不正确的是( )| A、在pH=13时,溶液中主要含磷物种浓度大小关系为c(HPO42-)>c(PO43-) |
| B、为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
| C、在pH=7.2时,HPO42-、H2PO4-的分布分数各为0.5,则H3PO4的Ka2=10-7.2 |
| D、Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向淀粉溶液中加入稀H2SO4,加热几分钟后,冷却再加入新制Cu(OH)2浊液,加热 | 没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| B | 灼烧一小块铝箔 | 熔化的铝并不滴落 | Al2O3的熔点高于Al |
| C | 用洁净的铂丝蘸取化合物X少许,放在酒精灯外焰上灼烧 | 火焰呈黄色, | X一定含钠元素 |
| D | 向Mg(OH)2悬浊液中滴加少量FeCl3溶液 | 出现红褐色沉淀 | Mg(OH)2溶解度大于Fe(OH)3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com