
| A. | 比较这两种元素的单质的硬度和熔点 | |
| B. | 向氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液 | |
| C. | 使在空气中久置的镁带和铝片分别与热水作用,并滴入酚酞溶液 | |
| D. | 将铝片和镁片分别投入氢氧化钠溶液中,Al能与NaOH溶液反应放出氢气,而Mg不能 |
分析 比较元素的金属性强弱,可根据金属与水、酸反应的剧烈程度以及对应的最高价氧化物的水化物的碱性强弱判断,以此解答该题.
解答 解:A.硬度和熔点属于物理性质,不能用于比较金属性,故A错误;
B.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液,氯化铝溶液先生成沉淀,后溶解,但不能证明金属性强弱,只能证明氢氧化铝为两性氢氧化物,故B错误;
C.元素的金属性越强,与水反应越剧烈,将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液,可观察到加入镁带的试管变红,铝片无现象,可证明镁的金属性强,故C正确;
D.将铝片和镁片分别投入氢氧化钠溶液中,Al能与NaOH溶液反应放出氢气,而Mg不能,如将镁换成铁,铁也不能,但铝比镁的金属性弱,比铁的强,则不能用于比较金属性强弱,比较金属金属性可以与稀非氧化性酸反应置换出氢气来比较,而不能用与碱反应来比较,故D错误.
故选C.
点评 本题考查金属性强弱的比较,题目难度不大,注意把握比较的角度,结合常见物质的性质解答,易错点为B、D.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 | |
| B. | 溶剂蒸发的速率越快,或浓缩后的溶液冷却得越快,析出的晶体颗粒就越大 | |
| C. | 油脂在热NaOH溶液中完全水解后加入饱和食盐水,可观察到液面上有固体析出 | |
| D. | 制备NaCl晶体时,晶体表面含有少量KNO3,用水淋洗后可得到较纯净的NaC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
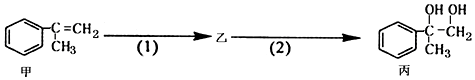
| A. | 物质丙能与氢氧化钠溶液反应 | |
| B. | 甲和丙均可使酸性KMnO4溶液褪色 | |
| C. | 反应(2)属于取代反应 | |
| D. | 步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
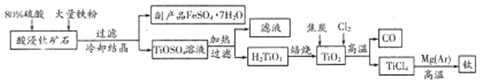
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
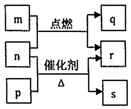 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:X<Y<Z | |
| B. | 非金属性:X>Y>Z | |
| C. | W、X、Y、Z四种元素可形成离子化合物 | |
| D. | q与s均为酸性氧化物,m的水溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木材纤维和土豆淀粉遇碘水均显蓝色 | |
| B. | 食用油反复加热会产生稠环芳烃等有害物质 | |
| C. | 误食铜、铅或汞等重金属盐中毒后应立即服用大量的牛奶 | |
| D. | 食用花生油和鸡蛋清都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35L | B. | 30L | C. | 25L | D. | 20 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
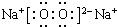 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com