
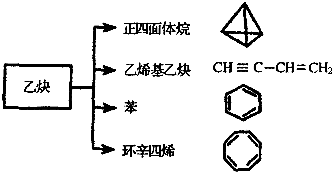
 ��Ȳ��һ����Ҫ���л�����ԭ�ϣ�����ȲΪԭ���ڲ�ͬ�ķ�Ӧ�����¿���ת�������£���ͼ�������
��Ȳ��һ����Ҫ���л�����ԭ�ϣ�����ȲΪԭ���ڲ�ͬ�ķ�Ӧ�����¿���ת�������£���ͼ�������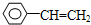 ��
�� ��
�� ��
�� ���� ��1�����������������ÿ���������һ��̼ԭ�ӣ�̼���γ�4�Թ��õ��Ӷԣ�ÿ��̼ԭ���϶�����һ����ԭ�ӣ�����Ϊ��������Գƽṹ��������ֻ��1��Hԭ�ӡ�ÿ��Cԭ����ֻ��1��Hԭ�ӣ��ݴ��ж������ȴ������ࣻ
��2��A����ϩ����ȲΪCH2=CH-C��CH��ÿ����ϩ����Ȳ�����к���һ��̼̼˫����һ��̼̼������
B��������ϩΪƽ��ṹ����ȲΪֱ�߽ṹ�����жϣ�
C����ϩ����Ȳ�����к���̼̼˫����̼̼������
D�����ݶ��ߵ����ʽ�����жϣ�
��3��������ϩ�ķ���ʽΪC8H8�������Ͷ�Ϊ5�����ڷ�������ͬ���칹�壬����1�����������������Ͷ�Ϊ1���ʺ���1������Ϊ-CH=CH2��
��4��һ�ȴ���ֻ�����ֱ���ͬϵ��ڽṹ��Ӧ���нϺõĶԳ��ԣ��ȴ�ʱ������ȡ�������ϵ��⣬Ҳ����ȡ�������ϵ��⣬�Բ���Ϊ�����
��� �⣺��1�����������������ÿ���������һ��̼ԭ�ӣ�̼���γ�4�Թ��õ��Ӷԣ�ÿ��̼ԭ���϶�����һ����ԭ�ӣ�����������ķ���ʽΪC4H4��
�������������Ϊ��������Գƽṹ��������ֻ��1��Hԭ�ӣ��������ȴ�����ֻ��1�֣�
�ʴ�Ϊ��C4H4��1��
��2��A������ϩ����ȲΪCH2=CH-C��CH����ϩ����Ȳ�����к���һ��̼̼˫����һ��̼̼������������̼̼˫����̼̼��������ʹ��ˮ��ɫ����A��ȷ��
B��̼̼�����ϵ�C��ͬһ��ֱ���ϣ���̼̼˫�������ӵ�ֻ̼�ܹ�ƽ�棬���Ṳֱ�ߣ���B����
C����ϩ����Ȳ�����к��еĹ����������֣�̼̼˫����̼̼��������C��ȷ��
D����ϩ����ȲΪCH2=CH-C��CH���ʽΪCH����ȲC2H2�����ʽΪCH���������ʽ��ͬ��������ͬʱ��������һ����ͬ����D��ȷ��
�ʴ�Ϊ��B��
��3��������ϩ�ķ���ʽΪC8H8�������Ͷ�Ϊ5�����ڷ�������ͬ���칹�壬����1�����������������Ͷ�Ϊ1���ʺ���1������Ϊ-CH=CH2�����ڷ�������ͬ���칹��Ľṹ��ʽ��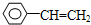 ��
��
�ʴ�Ϊ��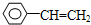 ��
��
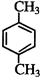
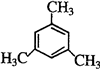
��4���뱽��Ϊͬϵ�����Ϊ�����һ�ȴ���ֻ�����֣�˵�����л�����ֻ��2��Hԭ�ӣ��뱽��Ϊͬϵ����һ�ȴ������������ʣ����뿼�ǶԳƽṹ���������ȡ����-CH3������������������ʵĽṹ��ʽΪ�� ��
�� �ȣ�
�ȣ�
�ʴ�Ϊ�� ��
�� ��
��
���� ��������ȲΪԭ�ϵ��л��ϳ�Ϊ���壬�����л���Ľṹ�����ʡ�ͬ���칹��ȣ���Ŀ�Ѷ��еȣ���ȷ�����л���ṹ������Ϊ���ؼ��������ֿ�����ѧ������ѧ֪ʶ���ۺ�����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
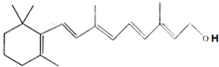 ����������������ȷ���ǣ�������
����������������ȷ���ǣ�������| A�� | ά����A1��һ��������ˮ�Ĵ� | |
| B�� | ά����A1�����к��б����ṹ | |
| C�� | ά����A1��ʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ����ԭ����ͬ | |
| D�� | 1molά����A1�ڴ��������£������5molH2�����ӳɷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
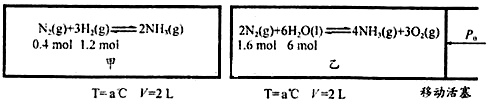
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2H2��g��+O2��g���T2H2O ��l����H=-285.8 kJ•mol-1 | |
| B�� | 2H2��g��+O2��g���T2H2O ��l����H=+571.6 kJ•mol-1 | |
| C�� | 2H2��g��+O2��g���T2H2O ��g����H=-571.6 kJ•mol-1 | |
| D�� | H2��g��+1/2O2��g���TH2O ��l����H=-285.8 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
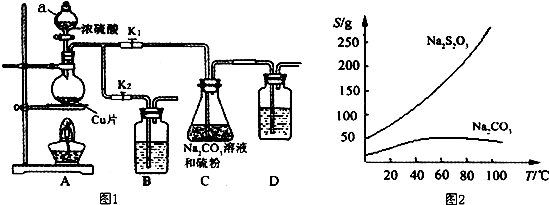
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ֲ���Ͳ���ʹ������Ȼ�̼��Һ��ɫ | |
| B�� | ����ˮ������ղ����������� | |
| C�� | �������ܷ���������Ӧ��ˮ�ⷴӦ | |
| D�� | Ӳ֬�����֬����Է�������Ϊ890���������ڸ߷��ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH=3��������Һ��pH=11�İ�ˮ�������ϣ�c��Cl-����c��NH4+����c��OH-����c��H+�� | |
| B�� | 0.1 mol•L-1 Na2CO3��Һ�У�c��Na+��+c��H+��=c��HCO3-��+c��CO32-��+c��OH-�� | |
| C�� | 0.1 mol•L-1 NaHS��Һ�У�c��H+��+c��H2S��=c��S2-��+c��OH-�� | |
| D�� | ���ʵ���Ũ����ȵ�HF��NaF��Һ�������Ϻ�c��Na+��=c��HF��+c��F-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com