
【题目】“民以食为天,食以安为先”,下列做法会危害食品安全的是
A. 回收餐桌废油加工成化工原料 B. 给蔬菜瓜果喷洒甲醛溶液
C. 做菜时加适量的酱油调味細味 D. 用食盐作食物防腐剂
科目:高中化学 来源: 题型:
【题目】用NaOH标准溶液对某醋酸溶液的浓度进行标定。回答下列问题:
(1)实验用品有:0.2000 mol/L的NaOH溶液,醋酸溶液,蒸馏水;pH计,酸式滴定管,碱式滴定管,锥形瓶,烧杯,铁架台。还缺少的一种仪器是____________。
(2)为标定该醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 19.95 |
该醋酸溶液的准确浓度为_____________(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_______________。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滥用药物有碍健康,下列有关用药的叙述正确的是
A. 长期大量服用阿司匹林可预防感冒
B. 运动员长期服用麻黄碱可提高成绩
C. 服用氢氧化钠溶液可中和过多的胃酸
D. 注射青霉素前要先做皮肤敏感试验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业产生的废气COx、NOx、SOx对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)已知甲烷的燃烧热为890 kJ/mol;1 mol水蒸气变成液态水放热44 kJ;N2与O2反应生成NO的过程如下:

则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=_______.
(2)汽车尾气中含有CO和NO,某研究小组利用反应:2CO(g)+2NO(g) ![]() N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:
N2 (g)+2CO2 (g)实现气体的无害化排放。T1℃时,在恒容的密闭容器中通入一定量的CO和NO,能自发进行上述反应,测得不同时间的NO和CO的浓度如下表:

①0~2 s内用N2表示的化学反应速率为____,该温度下,反应的平衡常数K1_____。
②若该反应在绝热恒容条件下进行,则反应达到平衡后体系的温度为T2℃,此时的化学平衡常数为K2,则K1____K2(填“>”、“<”或“=”),原因是________
(3)向甲、乙两个容积均为1 L的恒温恒容的密闭容器中,分别充入一定量的SO2和O2(其中,甲充入2 mol SO2、1 mol O2,乙充入1 mol SO2、0.5 mol O2),发生反应:2SO2(g)+O2 (g) ![]() 2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______
2SO3 (g) △H= -197. 74 kJ/mol ,一段时间后达到平衡,测得两容器中c(SO2)(mol/L)随时间t(min)的变化关系如右图所示。下列说法正确的是______

A.放出的热量Q:Q(甲)>2Q(乙)
B.体系总压强p:p(甲)>2p(乙)
C.甲容器达到化学平衡时,其化学平衡常数为4
D.保持其他条件不变,若起始时向乙中充入0.4 mol SO2、0.2mol O2、0.4 molSO3,则此时v(正>v(逆)
(4)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如右图所示。

①该工艺中能量转化方式主要有____。
②电解时,生成乙烯的电极反应式是____。
(5)CO2在自然界循环时可与CaC03反应,Ca-CO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2 CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2 CO3溶液混合,若Na2 C03溶液的浓度为2×10-4 mol/L,则生成沉淀所需CaCl2溶液的最小浓度为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)官能团与有机物的性质密切相关。
①下列物质易溶于水的是_____________________(填字母)。
a.异丁烷 b.乙醇 c.氯乙烯
②下列物质不能发生水解反应的是_____________________(填字母)。
a.葡萄糖 b.溴乙烷 c.乙酸乙酯
③可用酸性KMnO4溶液鉴别的一组物质是_____________________(填字母)。
a.甲烷与乙烷 b.乙烯与乙炔 c.苯和甲苯
(2)对香豆酸的结构简式如右图所示。
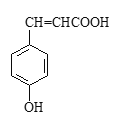
①对香豆酸分子中位于同一平面的碳原子最多有_____________________个。
②1mol对香豆酸最多可与____________________ molH2发生加成反应。
③聚对香豆酸的结构简式为____________________。
(3)D(胡椒醛)是一种食品香料,以A为原料制备D的一种合成路线如下:
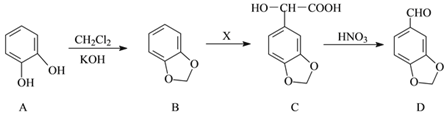
①A→B的反应类型是____________________;C中的含氧官能团名称为_____________________和____________________(填二种)。
②X的分子式为C2H2O3,B→C为加成反应,X的结构简式为____________________。
③芳香化合物Y是D的同分异构体,Y既能与NaHCO3反应生成CO2又能发生银镜反应,苯环上的一硝基取代物只有二种。符合题意的Y的结构简式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:
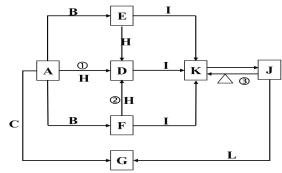
回答下列问题:
(1)A是:_____,C是:_____,L是:______,I是:____(填化学式)。
(2)写出反应①②③的化学反应方程式:
①:____________________________________;
②:____________________________________;
③:____________________________________;
(3)F可作为航天飞船中的供氧剂使用,若要制的氧气含量为25%的空气89.6 L(标况),则需要F的质量为_____g,反应中转移电子的个数为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ni-MH电池在工农业生产和日常生活中具有广泛用途,废旧电池中含有大量金属元素,其回收利用具有非常重要的意义。一种利用废Ni-MH电池正极材料(主要含有Ni(OH)2,还含有少量Fe、Cu、Ca、Mg、Mn、Zn的氢氧化物)制备电子级硫酸镍晶体的工艺流程如下图所示:

回答下列问题:
(1)“浸出”时温度、硫酸浓度、浸出时间对镍浸出率的影响如下图:
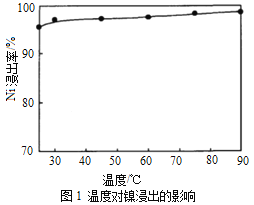
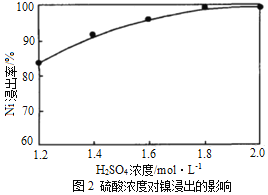
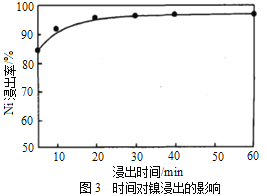
则“浸出”时最适宜的条件为_______________。
(2)在“滤液1”中加入双氧水可将Fe2+转化为难溶的针铁矿(FeOOH),写出反应的离子方程式:______________。
(3)“滤液2”中加入NaF可将滤液中Ca2+、Mg2+转化为难溶的CaF2和MgF2。当加入过量NaF后,所得“滤液3”中c(Mg2+)∶c(Ca2+)=0.67,则MgF2的溶度积为_____________[已知Ksp(CaF2)=1.10×10-10]。
(4)向“滤液3”中加入(NH4)2S2O8可以除锰,在此过程中(NH4)2S2O8与MnSO4反应生成含锰元素的一种黑色不溶物、硫酸铵及硫酸,写出该反应的化学方程式___________________。
(5)向“滤液4”加入有机萃取剂后,Zn2+与有机萃取剂(用HA表示)形成易溶于萃取剂的络合物ZnA2·2HA。该过程可以表示为:Zn2++4HA![]() ZnA2·2HA+2H+
ZnA2·2HA+2H+
①已知加入萃取剂后,锌的萃取率随料液pH变化如图所示。试分析pH增大时,锌的萃取率逐渐增大的原因是___________________。
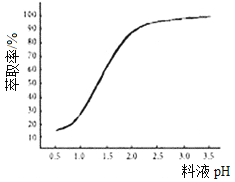
②“操作X”的名称是_____________。
(6)上述回收镍的过程中,使用了1kg含镍37.1%的正极材料,最终得到纯净的NiSO4·7H2O1.686kg,则镍的回收率为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞是一种治疗急性脑缺血的药物,部分合成流程如下。下列说法正确的是( )

A. 化合物X、Y和丁苯酞三种分子中各含有1个手性碳原子
B. 化合物Y可以发生取代、加成和加聚反应
C. 可用Na2CO3溶液鉴别化合物X和化合物Y
D. 化合物X、Y和丁苯酞各1 mol最多消耗NaOH的量均为1 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com