
| A. | 2H2(g)+O2(g)=2H2O(l)△H=-142.9 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=+571.6 kJ•mol-1 | |
| C. | H2(g)+$\frac{1}{2}$O2(g)=2H2O(g)△H=-285.8 kJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=2H2O(l)△H=-285.8 kJ•mol-1 |
分析 书写热化学方程式除了要遵循书写化学方程式的要求外,还应注意以下几方面:
(1)必须注明各反应物、生成物的状态(s、l、g、aq),不标“↑”和“↓”符号;
(2)反应热△H与测定条件(温度、压强)有关,若不说明则指常温(25℃)、常压(101kPa)下;
(3)△H只能写在标有反应物或生成物状态的化学方程式的右边,若为吸热反应,△H为“+”;若为放热反应,△H为“-”,△H的单位一般为kJ/mol;
(4)热化学方程式中的化学计量数仅表示该物质的物质的量,不表示物质的分子或原子数,因此可以是整数或分数;
(5)△H与热化学方程式中化学式前面的化学计量数成正比,当反应逆向进行时,其反应热与正反应的反应热数值相等,但符号相反.
解答 解:A.2mol氢气燃烧生成液态水,放出的热量为142.9kJ×4=571.6kJ,所以△H=-571.6kJ•mol-1,故A错误;
B.2mol氢气燃烧生成液态水,放出的热量为142.9kJ×4=571.6kJ,所以△H=-571.6kJ•mol-1,故B错误;
C.物质的状态影响反应热,生成物是气态水,题目条件不足,无法计算,故C错误;
D.△H与热化学方程式中化学式的计量数成正比,2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1,所以H2(g)+$\frac{1}{2}$O2(g)=2H2O(l)△H=-285.8 kJ•mol-1,故D正确;
故选:D.
点评 本题考查热化学方程式,题目难度不大,注意热化学方程式的书写方法.


科目:高中化学 来源: 题型:解答题
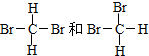 (在横线上填相应的序号)
(在横线上填相应的序号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素中X的气态氢化物最稳定 | |
| B. | X、Y、Z所形成的化合物只含有共价键 | |
| C. | Z的最高价氧化物对应的水化物化学式为H3ZO4 | |
| D. | X与Y可形成共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙受热分解 | B. | 铁在氯气中燃烧 | ||
| C. | 钠跟水反应 | D. | 氯化钠与硝酸银溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(N2)=0.25mol•L-1•min-1 | B. | v(H2)=0.5mol•L-1•min-1 | ||
| C. | v(NH3)=1mol•L-1•min-1 | D. | v(NH3)=0.25mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
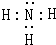 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| R | ||
| X | Y | Z |
| A. | 原子半径大小顺序是:Y>X>R | |
| B. | 其气态氢化物的稳定性顺序是:Z>Y>X>R | |
| C. | X、Y、Z中Z的氧化物对应的水化物的酸性最强 | |
| D. | R的气态氢化物与它的含氧酸之间能发生化学反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com