
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:
A(g)B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
| 时间t/h | 0 | 1 | 2 | 3 | 8 |
| 总压强p/100 kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 |
| 时间t/h | 16 | 20 | 25 | 30 | |
| 总压强p/100 kPa | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为________。
(2)由总压强p和起始压强p0计算反应物A的转化率α(A)的表达式为________,平衡时A的转化率为________,列式并计算反应的平衡常数K________。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总=________mol,n(A)=________mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
| 反应时间t/h | 0 | 4 | 8 | 16 |
| c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.006 5 |
分析该反应中反应物的浓度c(A)变化与时间间隔(Δt)的规律,得出的结论是________________________________________,由此规律推出反应在12 h时反应物的浓度c(A)为________ mol·L-1。
解析 (1)A(g)B(g)+C(g)的正向反应是一个气体体积增大的吸热反应,故可通过降低压强、升温等方法提高A的转化率。(2)在温度一定、容积一定的条件下,气体的压强之比等于其物质的量(物质的量浓度)之比。求解平衡常数时,可利用求得的平衡转化率并借助“三行式”进行,不能用压强代替浓度代入。(3)n(A)的求算也借助“三行式”进行。a=0.051,从表中数据不难得出:每隔4 h,A的浓度约减少一半,依此规律,12 h时,A的浓度为0.013 mol/L。
答案 (1)升高温度、降低压强
(2)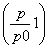 ×100% 94.1%
×100% 94.1%
A(g) B(g) + C(g)
0.10 0 0
0.10×(1-94.1%) 0.10×94.1% 0.10×94.1%
K=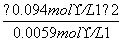 =1.5 mol·L-1
=1.5 mol·L-1
(3)①0.10×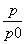 0.10×
0.10×
②0.051
达到平衡前每间隔4 h,c(A)减少约一半
0.013


科目:高中化学 来源: 题型:
下列实验中,所采取的分离方法与对应原理都正确的是
| 选项 | 目的 | 分离方法 | 原理 |
| A. | 分离溶于水的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B. | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C. | 除去丁醇中的乙醚 | 蒸馏 | 丁醇与乙醚的沸点相差较大 |
| D. | 除去KNO3固体中混杂的NaCl | 重结晶 | NaCl在水中的溶解度很大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
聚酰胺66常用于生产帐蓬、渔网、降落伞及弹力丝袜等织物,可利用下列
路线合成:
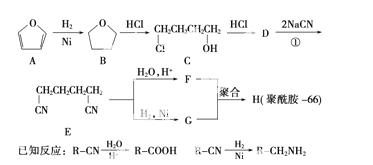
(1)能与银氨溶液反应的B的同分异构体的结构简式为__________________________。
(2)D的结构简式为________________;①的反应类型为________________。
(3)为检验D中的官能团,所用试剂包括NaOH水溶液及________________________。
(4)由F和G生成H的反应方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
普通玻璃、钢铁和玻璃钢是三种不同的材料,它们在性能方面差别很大。请根据学过的知识,回答下面问题。
(1)普通玻璃的成分是____________________________________________。
(2)铁在人类的生产和生活中有着十分重要的应用。铁的应用,经历了________到________到________的演变过程。
(3)某种复合材料具有耐高温、强度高、导电性好、导热性好的特点,估计该复合材料的基体和增强体材料可能分别是( )
A.金属;碳纤维 B.陶瓷;SiO2
C.合成树脂;SiO2、Al2O3、MgO D.合成树脂;碳纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中发生反应:aA(g)cC(g)+dD(g),达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡浓度的1.8倍。下列叙述正确的是( )
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a<c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学实验事实及解释都正确的是 ( )
A.用滴有少量硫酸铜溶液的稀硫酸跟锌粒反应快速地制氢气,说明Cu2+具有催化能力
B.升高温度会加快化学反应速率,其原因是增加了单位体积内活化分子的百分数
C.等体积、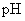 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说
都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说
明酸性: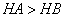
D.向浓度均为0.1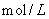 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成
的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成
Cu(OH)2沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]。
查看答案和解析>>
科目:高中化学 来源: 题型:
化工生产中常用MnS作沉淀剂除去工业废水中的Cu2+:
Cu2+(aq)+MnS(s)  CuS(s)+Mn2+(aq),下列说法错误的是( )
CuS(s)+Mn2+(aq),下列说法错误的是( )
A.MnS的Ksp比CuS的Ksp大
B.该反应达到平衡时:c(Mn2+)/c(Cu2+) =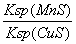
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)变大
D.MnS(s)的浊液中加入少量可溶性MnSO4固体后, c(S2-)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
A.定容时俯视液面 B.转移溶液前溶液未冷却至室温
C.容量瓶未干燥 D.未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)为了测定一定质量氯化钠样品中硫酸钠杂质的含量,将样品配成溶液,先加入过量的氯化钡溶液,然后过滤、洗涤、烘干、称量,通过硫酸钡的质量计算出硫酸钠的含量。回答下列问题:
①为什么加入过量的氯化钡溶液?
②如何判断氯化钡溶液已过量?
③如何洗涤沉淀? 。
(2)用量筒量取一定体积的液体时,若采用俯视的方法量取20 mL液体,则实际量取的液体的体积比20 mL ,若量筒中实际有20 mL液体,而你读数时采用了俯视的方法,则读得的数据比20 mL 。
(3)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。
答:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com