
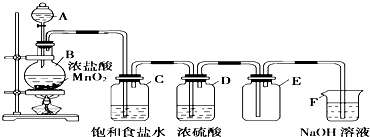
 如图为两套实验装置.
如图为两套实验装置.
分析 (1)根据仪器的结构特点判断;
(2)有活塞和玻璃塞的仪器使用时必须检查是否漏水;
(3)分离四氯化碳和酒精的混合物需用蒸馏,必须用酒精灯加热;
(4)根据配制一定物质的量浓度的溶液的方法和操作来寻找装置中的错误;
(5)根据左码右物称量药品时,药品的实际质量=砝码的质量-游码的质量;依据m=CVM计算需要氢氧化钠的质量;
(6)分析操作对溶质的物质的量和溶液体积的影响,依据C=n/V进行误差分析;
(7)根据配制溶液的原则,水加多了该重新配制.
解答 解:(1)①为蒸馏烧瓶,②为冷凝管,故答案为:蒸馏烧瓶;冷凝管;
(2)100mL容量瓶在使用前要检查是否漏水,蒸馏烧瓶、冷凝管不需要检查是否漏水,故答案为:④;
(3)分离四氯化碳和酒精的混合物用蒸馏的方法分离,必须用温度计,冷凝管的水采用逆流原理,冷却效果好,
故答案为:温度计;g;
(4)配制一定物质的量浓度的溶液是必须用玻璃棒引流,防止液体外溅,配制多大体积的溶液则选择多大规格的容量瓶,未用玻璃棒引流,未采用250ml容量瓶,
故答案为:未用玻璃棒引流,未采用250ml容量瓶;
(5)图中物质和砝码的位置放反了,质量关系应为:砝码的质量=烧杯的质量+游码显示的质量.即30 g=烧杯的质量+2.6 g,得烧杯的质量为:30g-2.6g=27.4g;NaOH固体配制1.0mol•L-1的NaOH溶液250mL,需要氢氧化钠的质量m=1.0mol/L×0.25L×40g/mol=10.0g,
故答案为:27.4;10.0;
(6)①没有洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低;
②转移溶液时不慎有少量洒到容量瓶外面,导致溶质的物质的量偏小,溶液浓度偏低;
③容量瓶不干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变;
④定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
⑤未冷却到室温就将溶液转移到容量瓶并定容,冷却后,液面下降,溶液浓度偏高;
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低.
故选:④⑤,③.
点评 本题考查常见仪器的使用和化学基本操作的方法,题目难度不大,注意在学习中加强基础知识的积累.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2═C(CH3)CH2CH2CH3 | B. | CH3C(CH3)═CHCH2CH3 | ||
| C. | CH2═CHCH(CH3)CH2CH3 | D. | CH3CH=CHCH(CH3)CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶前需检查它是否漏水 | |
| B. | 将蒸馏水注入容量瓶中,液面离刻度线下1-2cm时,改用胶头滴管滴加至液面与刻度线相切 | |
| C. | 配制溶液时,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水至刻度线 | |
| D. | 定容后盖好瓶塞,反复上下颠倒,摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
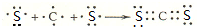 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com