
分析 (1)根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数,H3O+中含有3个δ键和1个孤电子对,O原子呈sp3杂化;
(2)同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,含有孤电子对和含有空轨道的原子之间存在配位键.
解答 解:(1)H3O+中O原子价层电子对个数是4且含1个孤电子对,分子的立体构型为三角锥形,O原子呈sp3杂化,
故答案为:三角锥型,Sp3;
(2)同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,该微粒中只存在H-O极性键,含有孤电子对和含有空轨道的原子之间存在配位键,氢离子含有空轨道、O原子含有孤电子对,所以该微粒中含有配位键,
故答案为:极性共价键 配位键.
点评 本题考查物质结构和性质,为高频考点,涉及原子杂化方式判断、微粒空间构型判断、配位键、极性键等知识点,熟练掌握价层电子对互斥理论并灵活运用,注意配位键属于共价键,为易错点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
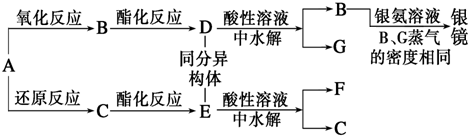
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,正确的是( )
,正确的是( )| A. | 3,3-二甲基-2-乙基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 2-乙基-3,3-二甲基戊烷 | D. | 3,4,4-三甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
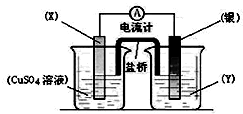 用如图装置实现原电池反应:Cu+2Ag+═Cu2++2Ag
用如图装置实现原电池反应:Cu+2Ag+═Cu2++2Ag查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮、磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题:
氮、磷、硫、氯、砷等是农药中的重要组成元素.回答下列问题: 是一种天然植物杀虫剂,其中N原子的杂化方式为sp3
是一种天然植物杀虫剂,其中N原子的杂化方式为sp3查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 纯净水 | B. | 0.1mol•L-1HCl | ||
| C. | 1.0mol•L-1CH3COOH | D. | 0.5mol•L-1H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
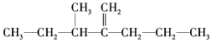 的系统命名为:3-甲基-2-丙基-1-戊烯
的系统命名为:3-甲基-2-丙基-1-戊烯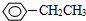 ③?H COOH、④CH3COOC2H5.
③?H COOH、④CH3COOC2H5.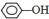 ;②CH2=CH2;③CH≡CH;④
;②CH2=CH2;③CH≡CH;④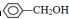 ;⑤
;⑤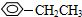 ;
;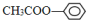 ;⑦CH3CH2CH2CH2Br中能与NaOH溶液反应,但不能与Na2CO3溶液反应的是⑥⑦. (填写上述物质的序号)
;⑦CH3CH2CH2CH2Br中能与NaOH溶液反应,但不能与Na2CO3溶液反应的是⑥⑦. (填写上述物质的序号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com