

| ||
| ||


科目:高中化学 来源: 题型:
| A、卤化氢中,以HF沸点最高 |
| B、水结成冰体积膨胀 |
| C、邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 |
| D、水加热到很高的温度都难以分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X为非电解质 |
| B、X是弱电解质 |
| C、X是强电解质 |
| D、X为易溶性盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
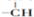 和一个
和一个 .则该有机物可能的结构有(不考虑立体异构)( )
.则该有机物可能的结构有(不考虑立体异构)( )| A、2种 | B、3种 | C、4种 | D、5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L的密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫元素在自然界中既有游离态,又有化合态 |
| B、被酸雨污染的农田及湖泊可洒石灰石粉末,减轻其危害 |
| C、检查病人胃病所用的钡餐,既可以用BaSO4,也可以用BaCO3 |
| D、SO2、SO3都为酸性氧化物,都可与水反应生成相应酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com