
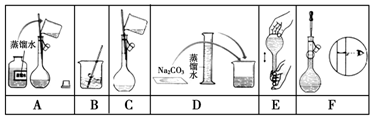
分析 (1)依据配制一定物质的量浓度溶液一般步骤排序;
(2)用Na2CO3•10H2O来配制溶液,若晶体已经部分失去结晶水,导致称取的碳酸钠的物质的量偏大,依据C=$\frac{n}{V}$进行误差分析;
(3)分析操作对溶质的物质的量和溶液体积的影响依据C=$\frac{n}{V}$进行误差分析;
(4)容量瓶不能盛放过热过冷液体,移液前应进行冷却.
解答 解:(1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,所以正确的顺序为:DBCAFE;
故答案为:DBCAFE;
(2)用Na2CO3•10H2O来配制溶液,若晶体已经部分失去结晶水,导致称取的碳酸钠的物质的量偏大,依据C=$\frac{n}{V}$可知溶液浓度偏高;
故答案为:偏高;
(3)步骤A通常称为洗涤,如果没有步骤A,导致溶质的物质的量偏小,则配得溶液的浓度将偏低;操作步骤F为定容;如果俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
故答案为:偏低; 定容;偏高;
(4)容量瓶不能盛放过热过冷液体,移液前应进行冷却;
故答案为:冷却至室温.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制一定物质的量浓度溶液的原理及操作是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1 NaCl溶液 | B. | 75 mL 2 mol•L-1 NH4Cl溶液 | ||
| C. | 150 L 3 mol•L-1 KCl溶液 | D. | 75 mL 1 mol•L-1 CaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NO的质量是30g | |
| B. | 标准状况下,1 mol H2O的体积是22.4 L | |
| C. | 17 g NH3含有的氢原子总数为6.02×1023 | |
| D. | 0.1 mol Na2CO3中,Na+的物质的量为 0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L溶液中含阴、阳离子总数是0.6NA | |
| B. | 500mL溶液中Βa2+的浓度是0.2mol•L-1 | |
| C. | 500mL溶液中NO-3的浓度是0.4mol•L-1 | |
| D. | 1L溶液中含有0.2NA个NO-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
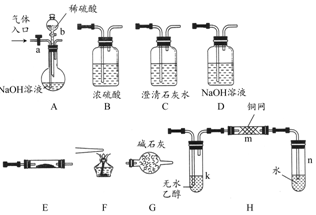 如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择).
如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②④ | C. | 只有②③④ | D. | 只有①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
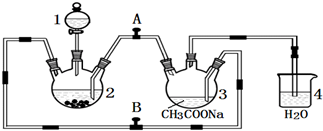
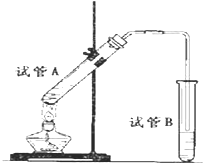 如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.
如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com