
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
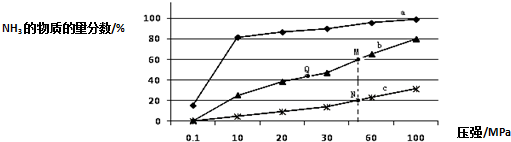
分析 (1)温度越高,K越大,说明升高温度,平衡正移;依据平衡三段式列式计算NO的平衡浓度,然后结合方程式计算出消耗氮气的物质的量,从而可计算出氮气的转化率;
(2)①正反应是放热反应,升高温度平衡逆向移动,氨气的含量减小;
②A.相同压强条件下,投料相同,温度越高反应速率越大,反应达到平衡时间越短;
B.催化剂能降低反应的活化能;
C.K只受温度影响,温度不变平衡常数不变,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
③根据反应N2(g)+3H2(g)?2NH3(g)利用三段式计算出平衡时各物质的浓度,并计算平衡常数;
(3)CH4在高温、催化剂作用下与水蒸气反应的方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g),生成2mol CO2吸收316kJ热量,则1molCH4叁加反应时需要吸收的热量为158kJ,CO2与K2CO3溶液反应生成碳酸氢钠钾,据此答题;
(4)生成的无污染的物质为氮气,根据电解原理写出阳极电极反应式.
解答 解:(1)由表格数据可知,温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应;
2260℃时,向2L密闭容器中充入0.3mol N2和0.3mol O2,20s时反应达平衡,设此时得到NO为xmol,
N2(g)+O2(g)?2NO(g)
开始 0.3mol 0.3mol 0
转化 $\frac{1}{2}$xmol $\frac{1}{2}$xmol xmol
平衡 (0.3-0.5x)mol (0.3-0.5x)mol xmol
化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,则化学平衡常数K=$\frac{{x}^{2}}{(0.3-0.5x)^{2}}$=1,解得:x=0.2,
则平衡时消耗氮气的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol,
所以平衡时氮气的转化率为:$\frac{0.1mol}{0.3mol}$×100%=33.3%,
故答案为:吸热;33.3%;
(2)①合成氨的反应为放热反应,反应温度越高,越不利于反应正向进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200℃,
故答案为:200℃;
②A.平衡常数与温度有关,与其他条件无关,温度相同时平衡常数相同,反应是放热反应,温度越高平衡常数越小,则M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故A正确;
B.工业合成氨之后所以加入催化剂,是因为加入催化剂有利于降低反应的活化能,从而加快了反应速率,故B错误;
C.相同压强条件下,投料相同,温度越高反应速率越大,反应达到平衡时间越短,温度:a<b<c,则达到平衡所需时间关系为c<b<a,故C错误;
故答案为:A;
③N点时氨的物质的量的分数为20%,利用三段式,设N2转化率是b,N2的起始浓度为a,
根据反应N2(g)+3H2(g)?2NH3(g)
起始 a 3a 0
转化 ab 3ab 2ab
平衡 a-ab 3a-3ab 2ab
根据题意有:$\frac{2ab}{a-ab+3a-3ab+2ab}$=20%、2ab=0.2,联立解得:a=0.3,b=$\frac{1}{3}$,
所以平衡常数K=$\frac{(2ab)^{2}}{(a-ab)×(3a-3ab)^{3}}$=$\frac{25}{27}$≈0.93,
故答案为:0.93;
(3)CH4在高温、催化剂作用下与水蒸气反应的方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g),生成2mol CO2吸收316kJ热量,则1molCH4叁加反应时需要吸收的热量为158kJ,所以反应的热化学方程式是CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol,CO2与K2CO3溶液反应生成碳酸氢钠钾,反应的离子方程式为CO32-+CO2+H2O=2HCO3-,
故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+158kJ/mol;CO32-+CO2+H2O=2HCO3-;
(4)利用电解法将NH3•H2O转化为对环境无污染的物质为氮气,阳极失去电子发生氧化反应,电极反应式为:2NH3-6e-+6OH-=N2+6H2O,
故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查较为综合,涉及热化学方程式的书写、化学平衡的计算、电解池原理、氧化还原反应的计算等知识,题目难度中等,注意利用三段式进行化学平衡的计算,明确反应速率的概念及计算方法,试题培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:多选题
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ•mol-1,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
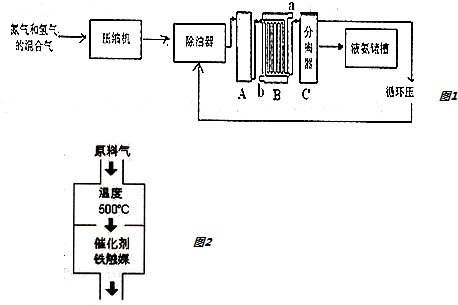
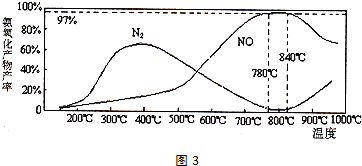
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
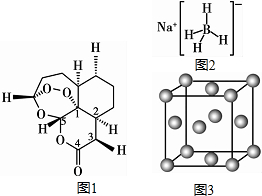 现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构
现有H、C、B、0、N、Na、Cu等七种元素,可形成多种物质.2015年10月中国药学家屠呦呦因发现青蒿素(含H、C、O元素)而获得诺贝尔生理医学奖,青蒿素( C15H22O5)的结构查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com