
分析 经5min达到平衡,此时生成2mol C,v(C)=$\frac{\frac{2mol}{4L}}{5min}$=0.1mol/(L•min),测得D的平均反应速率为0.15mol/(L•min),由反应速率之比等于化学计量数之比可知,$\frac{0.1}{0.15}=\frac{2}{x}$,解得x=3,则
3A(g)+B(g)?2C(g)+3D(g),
开始 6 5 0 0
转化 3 1 2 3
平衡 3 4 2 3
结合c=$\frac{n}{V}$、转化率=$\frac{转化的量}{开始的量}$×100%来解答.
解答 解:经5min达到平衡,此时生成2mol C,v(C)=$\frac{\frac{2mol}{4L}}{5min}$=0.1mol/(L•min),测得D的平均反应速率为0.15mol/(L•min),由反应速率之比等于化学计量数之比可知,$\frac{0.1}{0.15}=\frac{2}{x}$,解得x=3,则
3A(g)+B(g)?2C(g)+3D(g),
开始 6 5 0 0
转化 3 1 2 3
平衡 3 4 2 3
(1)平衡时A的物质的量浓度是$\frac{3mol}{4L}$=0.75mol/L;B的转化率是$\frac{1mol}{5mol}$×100%=20%,
故答案为:0.75mol/L;20%;
(2)由上述分析可知v(c):v(D)=2:x,则x=3,
答:x为3.
点评 本题考查化学平衡的计算,为高频考点,把握速率与化学计量数的关系、化学平衡三段法计算为解答的关键,侧重分析与计算能力的考查,注意x的确定方法,题目难度不大.


 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸与稀氨水反应:H++OH-=H2O | |
| B. | 碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O | |
| C. | 碘化钾溶液在酸性条件下被氧气氧化:4I-+O2+4H+=2I2+2H2O | |
| D. | 二氧化氮与水反应:2NO2+2H2O=2H-+2NO3-+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 6种 | C. | 9 种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的性质叙述不正确的是( )
的性质叙述不正确的是( )| A. | 能使溴水褪色 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 能发生加成反应 | |
| D. | 能发生加聚反应,且生成的聚合物也能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
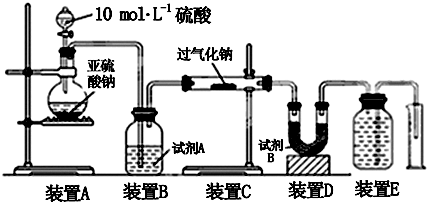
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物的量,化学反应速率一定加快 | |
| B. | 气体反应体系的压强增大,化学反应速率一定加快 | |
| C. | 与金属锌反应时,硫酸的浓度越大,产生H2速率越快 | |
| D. | 2molX气体在2L的容器中反应,4s后浓度变为0.5mol•L-1,则其反应速率为0.125mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减弱 | |
| B. | 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 | |
| C. | 在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成 | |
| D. | 因为AgCl比Ag2SO4更难溶,所以AgCl不会转化为Ag2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)═$\frac{1}{2}$HCl(g)△H=+92.4kJ/mol | B. | H2(g)+Cl2(g)═$\frac{1}{2}$HCl(g)△H=-92.4kJ/mol | ||
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-184.8kJ/mol | D. | H2(g)+Cl2(g)═2HCl(l)△H=+184.8kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com