
| 甲 | 乙 | 丙 | |
| ① | Al(OH)3 | KOH溶液 | 稀硫酸 |
| ② | SiO2 | NaOH溶液 | 氢氟酸 |
| ③ | N2 | O2 | H2 |
| ④ | Cu | FeCl3溶液 | 浓硝酸 |
| A. | ①②③④ | B. | ①②④ | C. | ①③④ | D. | ①④ |
分析 ①氢氧化铝是两性氢氧化物,能与强酸、强碱反应;
②二氧化硅与氢氧化钠反应生成硅酸钠,与氢氟酸反应生成四氟化硅;
③氮气与氧气在放电条件下反应得到NO,氮气与氢气在高温高压、催化剂条件下合成氨气反应;
④Cu与浓硝酸反应生成硝酸铜、二氧化氮与水,与氯化铁溶液反应得到氯化铜、氯化亚铁.
解答 解:①氢氧化铝是两性氢氧化物,能与氢氧化钠反应生成偏铝酸钠与水,与稀硫酸反应生成硫酸铝与水,故①正确;
②二氧化硅能与氢氧化钠反应反应生成硅酸钠与水,在酸中二氧化硅只与HF反应,生成四氟化硅,故②正确;
③氮气与氧气在放电条件下反应得到NO,氮气与氢气在高温高压、催化剂条件下合成氨气反应,常温下氮气不能与氧气、氢气发生反应,故③错误;
④常温下,Cu与浓硝酸反应生成硝酸铜、二氧化氮与水,与氯化铁溶液反应得到氯化铜、氯化亚铁,故④正确,
故选B.
点评 本题考查元素化合物性质,为高频考点,难度不大,侧重对基础知识的巩固,需要学生熟练掌握元素化合物性质.


科目:高中化学 来源: 题型:选择题
| A. | 1s、2px、2py、2pz轨道都具有球对称性 | |
| B. | 因为p轨道是“8”字形的,所以p电子也是“8”字形 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个轨道 | |
| D. | 原子轨道示意图与电子云图都是用来形象描述电子运动状态的图形 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氟化氧分子电子式: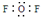 | |
| B. | 质子数与中子数相等的硫原子${\;}_{16}^{16}$S | |
| C. | 镁离子的结构示意图: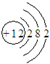 | |
| D. | 对甲基苯酚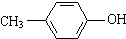 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:
叠氮化钠(NaN3)是汽车安全气囊中的主要成分,能在发生碰撞的瞬间分解产生大量气体将气囊鼓起.实验室测定叠氮化钠样品中NaN3的质量分数.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g | B. | 0.32g | C. | 3.2g | D. | 6.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
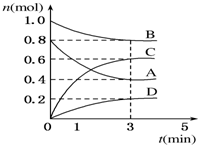 T℃时,在容积为0.5L的密闭容器中发生如 下反应.mA(g)+nB(g)?pC(g)+qD(s)△H<0(m、n、p、q为最简整数比).A、B、C、D的物质的量变化如图所示.
T℃时,在容积为0.5L的密闭容器中发生如 下反应.mA(g)+nB(g)?pC(g)+qD(s)△H<0(m、n、p、q为最简整数比).A、B、C、D的物质的量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com