
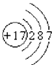 .
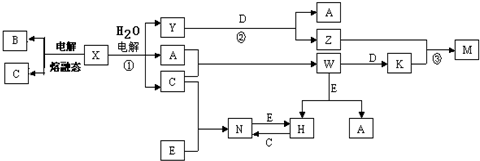
.分析 A、B、C、D、E是单质,X、Y、Z、M、N、W、H、K是化合物,B是短周期中原子半径最大的元素的单质,则B为Na;电解熔融X得到Na,则X为NaCl,C为Cl2,电解NaCl溶液得到Y、A、C,则A为H2、Y为NaOH,单质D与氢氧化钠反应得到氢气与Z,故D为Al、J为NaAlO2,A与C反应生成W为HCl,W与D反应生成K为AlCl3,Z与K反应生成M为Al(OH)3,E为应用广泛的金属单质,与HCl反应生成H,H能与氯气反应生成N,N与E反应由得到H,则E为变价金属,故E为Fe、H为FeCl2、N为FeCl3,据此解答.
解答 解:A、B、C、D、E是单质,X、Y、Z、M、N、W、H、K是化合物,B是短周期中原子半径最大的元素的单质,则B为Na;电解熔融X得到Na,则X为NaCl,C为Cl2,电解NaCl溶液得到Y、A、C,则A为H2、Y为NaOH,单质D与氢氧化钠反应得到氢气与Z,故D为Al、J为NaAlO2,A与C反应生成W为HCl,W与D反应生成K为AlCl3,Z与K反应生成M为Al(OH)3,E为应用广泛的金属单质,与HCl反应生成H,H能与氯气反应生成N,N与E反应由得到H,则E为变价金属,故E为Fe、H为FeCl2、N为FeCl3,
(1)C为Cl2,组成C的元素的原子结构示意图是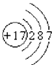 ,故答案为:
,故答案为: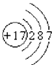 ;
;
(2)B为Na,在氧气中燃烧生成的产物为Na2O2,Na2O2与H2O反应的化学方程式:2Na2O2+2H2O═4NaOH+O2↑,
故答案为:2Na2O2+2H2O═4NaOH+O2↑;
(3)用惰性电极电解NaCl的水溶液的阴极反应方程式:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
(4)实验室制备Al(OH)3的化学方程式:AlCl3+3NH3•H2O=Al(OH)3↓+3 NH4Cl,
故答案为:AlCl3+3NH3•H2O=Al(OH)3↓+3 NH4Cl.
点评 本题考查无机物推断,涉及Na、Cl、Fe、Al元素化合物性质与转化及电解原理等,以B的原子半径为突破口进行推断,需要学生熟练掌握元素化合物知识,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
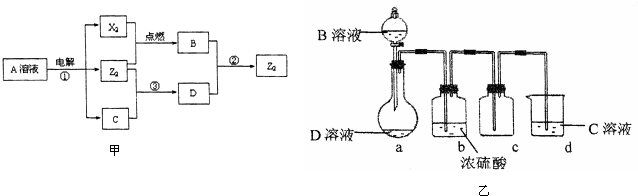
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 “盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2.下列关于该电池的说法错误的是( )
“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2.下列关于该电池的说法错误的是( )| A. | 镁片作为正极 | |
| B. | 食盐水作为电解质溶液 | |
| C. | 电池工作时镁片逐渐被消耗 | |
| D. | 电池工作时实现了化学能向电能的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
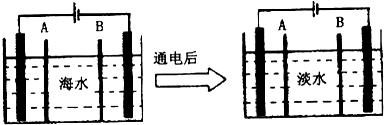
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲同学的方案可行 | |
| B. | 乙同学的方案可行 | |
| C. | 甲、乙两位同学的方案都有局限性 | |
| D. | 甲、乙两位同学的实验所涉及的卤代烃的性质一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 工业上用电解熔融的氯化物的方法制备金属镁和铝 | |
| B. | 适当提高合成氨原料气中N2的含量,可提高H2的转化率 | |
| C. | 从安全运输上看,硫酸厂靠近硫酸消费中心比靠近原料产地更为有利 | |
| D. | 利用反应NaCl(饱和)+CO2+NH3+H2O=NH4Cl+NaHCO3↓制取NaHCO3时,应在NaCl饱和溶液中先通入过量CO2再通入过量的NH3 | |
| E. | 硫酸厂生产时常采有高压条件提高SO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用加热分解法冶炼金属钾 | B. | 采用电解法冶炼金属铝和钠 | ||
| C. | 采用热还原法冶炼金属铁与汞 | D. | 采用热还原法冶炼金属铜与钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
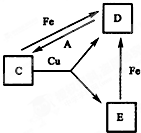 有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:
有A、B、C、D、E、F六种常见物质,将它们分别溶于水,所得溶液颜色各不相同.已知:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com