
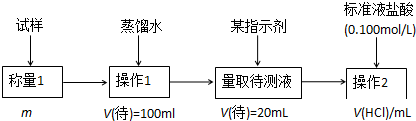
分析 方法一:固态样品加水溶解成100ml溶液,取20ml加指示剂,用标准盐酸进行滴定,从而计算出碳酸氢钠的质量分数;
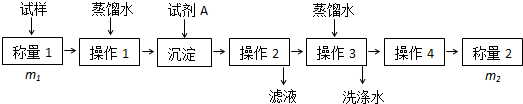
方法二:固态样品加试剂A使碳酸氢跟生成沉淀,再经过过滤、洗涤、干燥称量沉淀的质量,从而根据碳守恒计算碳酸氢钠的质量,进而计算质量分数;
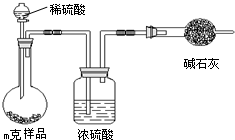
方法三:固态样品加稀硫酸充分溶解,再经过浓硫酸干燥,用碱石灰吸收生成的二氧化碳气体,根据二氧化碳的质量计算碳酸氢钠的质量,进而计算质量分数;
(1)根据方法二的原理分析所需仪器,滴定过程是中和滴定实验;根据滴定终点时溶液酸碱性选择指示剂;由所用盐酸的体积可计算出20mL的待测液中碳酸氢钠的物质的量,进而计算质量分数;
(2)根据以上分析:与HCO3-反应产生沉淀的试剂有Ca(OH)2或 Ba(OH)2,二者选其一即可;操作1、2、3、4的名称依次是溶解、过滤、洗涤、干燥;
(3)方法三利用产生二氧化碳的质量来计算碳酸氢钠的质量分数,所用需要称量装有碱石灰的干燥管在实验前后的质量;根据装置分析,偏高的原因是碱石灰还会吸收空气中的二氧化碳和水使质量增大;偏低的原因是装置中会有残留的二氧化碳未被吸收;
(4)不用其他化学试剂,就只能是碳酸氢钠的受热分解了,利用固体反应前后的质量差,计算碳酸氢钠的质量分数.
解答 解:(1)方法一中固态样品加水溶解成100ml溶液,操作1中要用到的玻璃仪器有烧杯、玻璃棒,还需要100mL的容量瓶,胶头滴管,操作2的名称是中和滴定;用标准盐酸进行滴定到终点时溶液还溶解了少量的二氧化碳,故呈酸性,而酚酞的变色范围是8~10,未滴定完已变色,不可用,应使用甲基橙作指示剂,溶液由黄色变为橙色,由于盐酸与碳酸氢钠按1:1反应,所以消耗盐酸的物质的量即为碳酸氢钠的物质的量,又配100ml,取20ml进行滴定,所以原液是待测液的5倍,所以样品中NaHCO3的质量为V(HCl)×10-3×0.100×5×84=0.042V(HCl)g,质量分数为$\frac{0.042V(HCl)}{m}$×100%,
故答案为:100mL容量瓶、胶头滴管;中和滴定; 甲基橙;$\frac{0.042V(HCl)}{m}$×100%;
(2)方法一:与HCO3-反应产生沉淀的试剂有Ca(OH)2或 Ba(OH)2,所以试剂A为Ca(OH)2或 Ba(OH)2;与与HCO3-反应产生沉淀后应进行的操作为过滤、洗涤、干燥,操作3为洗涤,取最后一次的洗涤液少许于试管中,加入硫酸(或硫酸盐),若无沉淀,说明洗涤已完全,判断这个目的已经达到,
故答案为:Ca(OH)2 或Ba(OH)2;洗涤;取最后一次的洗涤液少许于试管中,加入硫酸(或硫酸盐),若无沉淀,说明洗涤已完全;
(3)根据以上分析:方法三利用产生二氧化碳的质量来计算碳酸氢钠的质量分数,所用需要称量装有碱石灰的干燥管在实验前后的质量,为m(CO2)质量或实验前后干燥管的质量,因为碱石灰直接与空气接触,所以偏高的原因是碱石灰还会吸收空气中的二氧化碳和水使质量增大;因为装置中还会有残留的二氧化碳,所以偏低的原因是装置中会有残留的二氧化碳未被吸收,碱石灰可能还会吸收空气中的水气和CO2气体,圆底烧瓶内会留存部分CO2气体,空气中的二氧化碳、水蒸气等进入干燥管;装置中的二氧化碳没有全部排入干燥管,
故答案为:m(CO2)(或实验前后干燥管的质量);空气中的二氧化碳、水蒸气等进入干燥管;装置中的二氧化碳没有全部排入干燥管;
(4)不用其他化学试剂,就只能是碳酸氢钠的受热分解了,利用固体反应前后的质量差,计算碳酸氢钠的质量分数,化学方程式是2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,故答案为:2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
点评 本题主要考查对碳酸氢钠的质量分数的不同测定方法的分析计算,注意分析各种方法的原理,进而解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
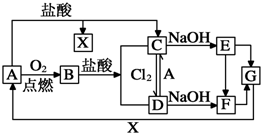 已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.
已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④⑤⑦ | C. | ②⑤⑥⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg失火不能用CO2灭火;Na失火也不能用CO2灭火 | |
| B. | Fe3O4可写成FeO•Fe2O3;Pb3O4也可写成PbO•Pb2O3 | |
| C. | Cu与Cl2直接化合生成CuCl2;Cu与S直接化合得到CuS | |
| D. | CO2通入到硝酸钡溶液中不能生成沉淀;SO2通入到硝酸钡溶液中也不能生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 14 | C. | 28 | D. | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHSO4固体是离子晶体 | |
| B. | NaHSO4晶体中阳离子和阴离子的个数是2:1 | |
| C. | NaHSO4晶体熔化时破坏的是离子键和共价键 | |
| D. | NaHSO4固体溶于水时既破坏离子键又破坏共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 碳酸钙溶于稀盐酸中 CO32─+2H+═CO2↑+H2O | |
| C. | 碳酸氢钠溶液与盐酸反应 HCO3─+H+═CO2↑+H2O | |
| D. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与NaOH溶液反应的离子方程式为:H++OH-═H2O | |
| B. | 金属钠与乙醇反应的化学方程式为:2Na+2CH3CH2OH→2CH3CH2ONa+H2↑ | |
| C. | 聚氯乙烯的结构简式为: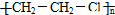 | |
| D. | 氯化铵的电子式为: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com