
| A. | 若p>q,则还原性cCp-<dDq- | |
| B. | 若m>n,则碱性A(OH)m>B(OH)n | |
| C. | 若半径aAm+>bBn+,则a<b | |
| D. | 若半径aAm+>bBn+,则A的单质一定能从含Bn+的盐溶液中置换出B |
分析 短周期元素的离子:aAm+、bBn+、cCp-、dDq-均具有相同的电子层结构,则有:a-m=b-n=c+p=d+q,则有A、B在周期表中C、D的下一周期,且A、B为金属元素,C、D为非金属元素,且阳离子带有的电荷越多,其原子序数越大,阴离子带有的电荷越多,其原子序数越小,结合元素周期律递变规律解答该题.
解答 解:短周期元素的离子:aAm+、bBn+、cCp-、dDq-均具有相同的电子层结构,则有:a-m=b-n=c+p=d+q,则有A、B在周期表中C、D的下一周期,且A、B为金属元素,C、D为非金属元素,同周期:阳离子带有的电荷越多,其原子序数越大,阴离子带有的电荷越多,其原子序数越小,
A.阴离子带有的电荷越多,其原子序数越小,若p>q,则原子序数C<D,同周期随着原子序数的增大,其阴离子的还原性减弱,所以还原性cCp->dDq-,故A错误;
B.阳离子带有的电荷越多,其原子序数越大,若m>n,则原子序数A>B,同周期随着原子序数的增大,其最高价氧化物的水化物的碱性减弱,则碱性A(OH)m<B(OH)n,故B错误;
C.同周期阳离子的半径,随原子序数增大而减小,若半径aAm+>bBn+,则a<b,故C正确;
D.若A为活泼性很强的金属如Na,则不能从溶液中置换金属,因为Na与水能反应生成氢气,故D错误.
故选C.
点评 本题考查位置结构性质的相互关系及应用,明确核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ |
| 实验 内容 |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价键只有方向性 | |
| B. | 离子晶体中只存在阴阳离子间的静电吸引力 | |
| C. | Na2O2中阴阳离子个数比为1:2 | |
| D. | 化学式CO2、SiO2、NaCl、CaH2都可以表示分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源.
汽车尾气中含有NO、CO和碳颗粒等有害物质,已成为某些大城市空气的主要污染源. 2NO;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因温度升高,反应速率加快.
2NO;汽车启动后,汽缸内温度越高,单位时间内NO排放量越大,试分析其原因温度升高,反应速率加快.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.08mol/L | B. | 0.08mol/(L•s) | C. | 0.04mol/(L•min) | D. | 0.04 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

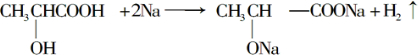 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①是取代反应,反应②③是氧化还原反应 | |
| B. | 水中溶解的NH3会导致水生动物死亡 | |
| C. | 向氨超标的河水中加稀硫酸是一种行之有效的处理方法 | |
| D. | 自来水中的HgCl2可加入Na2S处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com