
| A.同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B.核外电子排布相同的微粒化学性质也相同 |
| C.Cl?、S2?、Ca2+、K+半径逐渐减小 |
D. 与 与 得电子能力相同 得电子能力相同 |
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源:不详 题型:单选题

| A.气态氢化物的热稳定性:X>W | B.最高价氧化物对应水化物的酸性:Y>X |
| C.离子半径:Z>W | D.Z的氧化物中含有非极性共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.非金属性比硫强 | B.氢化物比HBr稳定 |
| C.原子序数为34 | D.最高价氧化物的水化物显碱性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
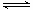 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | | m | n |
| x | y | | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
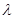 与光的频率v的关系为
与光的频率v的关系为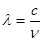 ,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因:
,其中光速c=3×108m·s-1。根据下表有关蛋白质分子中重要化学键的信息,求波长为300 nm的紫外光的光子所具有的能量 kJ·mol-1,说明人体长时间照射紫外光后皮肤是否会受伤害的原因: | 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.与C60中普通碳原子的化学性质不同 | B.与14N含的中子数相同 |
| C.是C60的同素异形体 | D.与12C互为同位素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com