
【题目】下列表格是元素周期表的一部分,请按要求填空
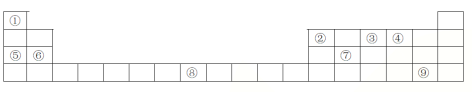
(1)元素①和⑤形成的化合物中存在的化学键类型为__________________
(2)写出由①②④形成的一种一元酸的分子式_________________
(3)写出由③形成的单质的电子式_________________
(4)列举元素⑦形成的氧化物一种用途________________;元素⑧在周期表中的位置 ____,
天津市有着丰富的海水资源,海水中元素⑤、⑥和⑨的含量很丰富,某化学兴趣小组先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。请回答下列问题
回答下列问题:
(5)海水淡化的方法主要是___________________________________(至少列举2种)
(6)采用“空气吹出法”从浓海水中吹出Br2,常温下,Br2的颜色为___________________。
吹出的溴用纯碱溶液吸收,吸收溴的主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+ NaHCO3(未配平),当吸收1mol Br2时,转移的电子数为________mol.
(7)从海水中获得元素⑤或⑥的化合物的一段工艺流程如图:
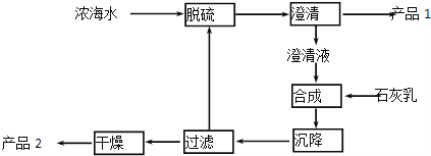
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,产品1的化学式为________________。产品2为Mg(OH)2。常温下向浓海水中滴加NaOH溶液,当Mg2+恰好完全沉淀时溶液的pH为_________。(已知25℃时Ksp[Mg(OH)2]=1.0×10-13)
(8)欲由MgCl2·6H2O加热制备MgCl2时,实验能取得成功的关键操作或条件是_________。
采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为______________
【答案】离子键H3BO3![]() 光导纤维、水晶饰品或制备硅等第四周期VIII族蒸馏法、离子交换膜法或电渗析法深红棕色5/3CaSO410在氯化氢气流保护下加热蒸干,或加入SOCl2后再加热蒸干MgCl2(熔融)
光导纤维、水晶饰品或制备硅等第四周期VIII族蒸馏法、离子交换膜法或电渗析法深红棕色5/3CaSO410在氯化氢气流保护下加热蒸干,或加入SOCl2后再加热蒸干MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
【解析】
结合元素周期表分析,①为氢,②为硼,③为氮,④为氧,⑤为钠,⑥为镁,⑦为硅,⑧为铁,⑨为溴。
(1)氢和钠形成氢化钠,含有离子键。(2)氢和硼和氧形成硼酸,分子式为H3BO3 。 (3)氮气的电子式为:![]() 。(4)二氧化硅可以做光导纤维、水晶饰品或制备硅等。铁在第四周期VIII族。(5)海水淡化的方法有蒸馏法、离子交换膜法或电渗析法;(6)单质溴为深红棕色。在反应3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3中,3mol反应时转移5mol电子,故当吸收1mol溴时,转移的电子为 5/3 mol。(7)工艺流程合成步骤中加入石灰乳,镁离子和氢氧化钙反应生成氢氧化镁沉淀和钙离子,过滤干燥的产品2为氢氧化镁,滤液中的钙离子进行脱硫,用钙离子沉淀硫酸根离子生成硫酸钙沉淀,采用过滤的方法得到的产品1为硫酸钙。氢氧化镁完全沉淀后镁离子浓度小于10-5mol/L,已知25℃时Ksp[Mg(OH)2]= c2(OH-)c(Mg2+)=1.0×10-13,则计算c(OH-)=10-4mol/L,c(H+)=
。(4)二氧化硅可以做光导纤维、水晶饰品或制备硅等。铁在第四周期VIII族。(5)海水淡化的方法有蒸馏法、离子交换膜法或电渗析法;(6)单质溴为深红棕色。在反应3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3中,3mol反应时转移5mol电子,故当吸收1mol溴时,转移的电子为 5/3 mol。(7)工艺流程合成步骤中加入石灰乳,镁离子和氢氧化钙反应生成氢氧化镁沉淀和钙离子,过滤干燥的产品2为氢氧化镁,滤液中的钙离子进行脱硫,用钙离子沉淀硫酸根离子生成硫酸钙沉淀,采用过滤的方法得到的产品1为硫酸钙。氢氧化镁完全沉淀后镁离子浓度小于10-5mol/L,已知25℃时Ksp[Mg(OH)2]= c2(OH-)c(Mg2+)=1.0×10-13,则计算c(OH-)=10-4mol/L,c(H+)= ![]() =10-10mol/L,计算pH=10。但镁离子恰好完全沉淀时溶液的pH为10。 (8)氯化镁中的镁离子容易水解,在干燥的氯化氢气流中,抑制镁离子水解,且带走氯化镁晶体受热产生的水汽,或加入SOCl2后,其水解生成氯化氢和二氧化硫,抑制了镁离子水解,故能得到无水氯化镁,在不锈钢做阴极电解熔融氯化镁时,阳极产生氧化反应生成氯气,阴极室镁离子得到电子生成金属镁,电解方程式为 MgCl2(熔融)
=10-10mol/L,计算pH=10。但镁离子恰好完全沉淀时溶液的pH为10。 (8)氯化镁中的镁离子容易水解,在干燥的氯化氢气流中,抑制镁离子水解,且带走氯化镁晶体受热产生的水汽,或加入SOCl2后,其水解生成氯化氢和二氧化硫,抑制了镁离子水解,故能得到无水氯化镁,在不锈钢做阴极电解熔融氯化镁时,阳极产生氧化反应生成氯气,阴极室镁离子得到电子生成金属镁,电解方程式为 MgCl2(熔融) ![]() Mg+Cl2↑。
Mg+Cl2↑。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分:

请按要求用化学用语回答下列问题:
(1)元素④、⑥、⑨的离子半径由大到小的顺序为________________;
(2)元素②、③、④的简单氢化物的沸点由低到高的顺序: _____________________;
(3)用电子式表示元素④与元素⑥形成的化合物的形成过程____________;
(4)比元素⑦的原子序数多17的元素在周期表的位置为________________;
(5)写出由①④⑤三种元素组成的一种离子化合物的电子式_______________,若将其溶于水,破坏了其中的__________(填“离子键”、“共价键”或“离子键和共价键”);
(6)元素①和元素④形成的化合物及元素①和元素⑧形成的化合物均为18电子分子,请写出这两种化合物按物质的量之比4:1反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F 是重要的有机化合物,可以由基础化合物 A 通过以下过程制得:
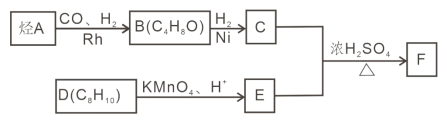
已知:①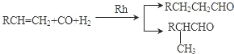
②核磁共振氢谱显示 C 的分子中含有 4 种不同化学环境的氢原子,且其峰面积之比为6:1:2:1;
③F是酯类化合物,分子中苯环上的一溴取代物只有两种。
(1)A 发生加聚反应的化学方程式是_____。
(2)B 物 质 的 名 称 为 _____; 检 验 B 中 官 能 团 的 实 验 操 作 方法___________。
(3)F 中的官能团的名称为_____;C+E→F 的化学方程式是_____。
(4)X 与 E 互为同分异构体,且 X 具有下列性质,符合条件的 X 有_____种(不考虑立体异构)。
①分子中含有苯环,且能与 NaHCO3 溶液反应生成二氧化碳气体
②与银氨溶液共热有银镜生成。
(5)设计由乙烯和必要的无机原料合成丙酸乙酯的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示。常温下,Al能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
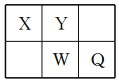
A. Y的最高化合价为+6
B. 简单氢化物的稳定性:Y>W
C. 简单离子半径:W>Q>Y>X
D. X、Y、W不可能同时存在于一种离子化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气质量报告中涉及的污染物主要是( )
A.Cl2、HCl 、酸雨B.SO2、NO2、可吸入颗粒物
C.NH3、CO、CO2D.SO2、N2、可吸入颗粒物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列冶炼金属的原理正确的是
A. 电解食盐水制备金属钠 B. 电解氯化铝制备金属铝
C. 用MgO与CO热还原法制备单质镁 D. 加热分解Ag2O制备金属银
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学选修3:物质结构与性质】
翡翠是玉石中的一种,其主要成分为硅酸铝钠-NaAI(Si2O6),常含微量Cr、Ni、Mn、Mg、Fe等元素。回答下列问题:
(l)基态Cr原子的电子排布式为____;Fe位于元素周期表的___ 区。
(2)翡翠中主要成分硅酸锚钠表示为氧化物的化学式为____,其中四种元素第一电离能由小到大的顺序是____。
(3)钙和铁部是第四周期元素,且原子的最外层电子数相同,为什么铁的熔沸点远大于钙?____。
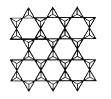
(4)在硅酸盐中存在![]() 结构单元,其中Si原子的杂化轨道类型为____。当无限多个(用n表示)
结构单元,其中Si原子的杂化轨道类型为____。当无限多个(用n表示)![]() 分别以3个顶角氧和其他3个
分别以3个顶角氧和其他3个![]() 形成层状结构时(如图所示),其中Si、O原子的数目之比为____。
形成层状结构时(如图所示),其中Si、O原子的数目之比为____。
若其中有一半的Si被Al替换,其化学式为____。
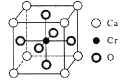
(5) Cr和Ca可以形成种具有特殊导电性的复合氧化物,晶胞结构如图所示。该晶体的化学式为____,若Ca与O的核间距离为x nm,则该晶体的密度为___ g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的某有机物与足量金属钠反应,可得VAL气体。相同质量的该有机物与适量的碳酸钠浓溶液反应,可得VBL气体。已知在同温、同压下VA和VB不相同,则该有机物可能是( )
A.CH2=CHCOOH
B.HOOC—COOH
C.CH3CH2COOH
D.HOOCCH2CH(OH)CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处有化学。请根据你所学过的化学知识,判断下列说法中错误的是
A.医疗上常用体积分数为70%~75%的酒精作消毒剂
B.为防止流感传染,可将教室门窗关闭后,用食醋熏蒸,进行消毒
C.海鲜、肉类等食品用福尔马林浸泡防腐保鲜
D.碘沾在手上立即用酒精洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com