
| A、分离FeCl3和AlCl3两种物质的混合物,只用氢氧化钠和二氧化碳即可 |
| B、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 |
| C、稀硫酸滴定未知浓度的NaHCO3溶液,用甲基橙作指示剂,溶液由黄色变为橙色 |
| D、在50mL量筒中配制0.1000mol?L-1碳酸钠溶液 |


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
| A、(8n-m)mol |
| B、(4m-n)mol |
| C、(4n-m)mol |
| D、(7n-m)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
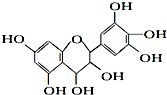
| A、该物质既可看作醇类,也可看作酚类 |
| B、1mol该物质可与4mol Br2反应 |
| C、1mol该物质可与7mol Na反应 |
| D、1mol该物质可与7mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 起始浓度(mol.L-l) | c(NH3) | c(O2) | c(NO) | c(H20) |
| 甲 | 1 | 2 | 0 | 0 |
| 乙 | 4 | 8 | 0 | 0 |
| 丙 | 0.2 | x | y | z |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①常用于分离互不相溶的液体 |
| B、装置②可用于实验室加热酒精与浓硫酸的混合物制取乙烯 |
| C、装置③可用于制备乙酸乙酯 |
| D、装置④可用于收集NO、CO2等气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温 度 | 200℃ | 300℃ | 400℃ |
| 平衡常数 | K1 | K2 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 前些天在北京、西安、南昌等25个大中城市都出现雾霾天气,人类的活动改变了全球的气候.全球气候变暖已经成为全世界人类面临的重大问题.
前些天在北京、西安、南昌等25个大中城市都出现雾霾天气,人类的活动改变了全球的气候.全球气候变暖已经成为全世界人类面临的重大问题.| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com