
| A. | 溶液的浓度增大 | |
| B. | 溶液的pH增大 | |
| C. | 溶液中钠离子与碳酸根离子的物质的量之比变小 | |
| D. | 溶液的质量分数不变 |
分析 惰性电极电解饱和碳酸钠溶液,移向阳极的是氢氧根离子、碳酸根离子,氢氧根离子放电失去电子发生氧化反应;移向阴极的是钠离子、氢离子,氢离子放电得到电子生成氢气,电解过程的实质是电解水;电解一时间后溶液中无晶体析出,说明还没有形成饱和溶液,据此进行解答.
解答 解:在盛有稀碳酸钠溶液的烧杯中插入惰性电极,电解实质为电解水,
A.水解过程中水不断减少,溶液体积减小,溶液中无晶体析出,则碳酸钠溶液的浓度会增大,故A正确;
B.电解过程中碳酸钠溶液浓度增大,溶液碱性增强,则溶液的pH增大,故B正确;
C.碳酸钠浓度越大,碳酸根离子的水解程度越小,则电解过程中钠离子和碳酸根离子的物质的量之比减小,故C正确;
D.电解过程中碳酸钠的质量不变,而溶液质量减小,则溶液的质量分数会增大,故D错误;
故选D.
点评 本题考查电解原理的应用,题目难度不大,明确电解实质为解答关键,注意掌握电解原理及影响盐的水解原理的因素,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6Cl2的有机物有4种同分异构体 | |
| B. | 包装用材料聚氯乙烯分子中含有碳碳双键 | |
| C. | 苯与液溴混合后加入铁粉发生了加成反应 | |
| D. | 1mol苹果酸(HOOCCHOHCH2COOH)可与3molNaHCO3发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 氢气 | 加热 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 D在周期表的位置:第三周期VIIA族.
D在周期表的位置:第三周期VIIA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
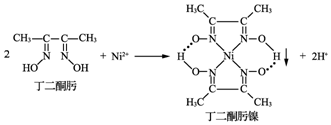
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与W可以形成Na2W2化合物 | |
| B. | Z与少量的氢氧化钠溶液反应生成两性氢氧化物 | |
| C. | X与氢元素只能形成含共价键的化合物 | |
| D. | WO2与XO2均为酸性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com