
| 反应序号 | CO2的物质的量/mol | NaOH溶液的体积/L | 放出的热量/KJ |
| 1 | 0.5 | 0.75 | x |
| 2 | 1.0 | 2.00 | y |
| 温度 t/min | 0 | 40 | 80 | 120 | 160 |
| 甲(673K) | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| 乙(T) | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
| 丙(673K) | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
分析 (1)根据题意可知,22gCO2通入1mol/L NaOH溶液750mL中充分反应,测得反应放出xkJ的热量,写出热化学反应方程式,再利用1mol CO2通入2mol/L NaOH溶液2L中充分反应放出y kJ的热量写出热化学反应方程式,最后利用盖斯定律来书写CO2与NaOH溶液反应生成NaHCO3的热化学方程式;
(2)①甲容器中,根据表中数据,0~40min内,NO的物质的量改变量为△n=2.00-1.50=0.50mol,反应经历的时间为△t=40min,容器体积V=1L,根据化学反应平均速率计算公式v(NO)=$\frac{△n}{V△t}$计算;
②注意甲和乙,起始物料相同,温度不同,从0~40min看,乙容器的化学反应速率比甲的快,温度升高能加快化学反应速率,因此乙容器的温度大于甲容器的温度,但乙容器中NO的转化率低于甲容器,所以表现为升高温度,平衡向逆反应方向移动,据此判断该反应的焓变正负;
③根据表中数据,丙容器中NO的起始物质的量为1.00mol,丙容器与甲容器的温度相同,则两容器反应的平衡常数也相同,据此计算;
(3)NH4HCO3为弱酸弱碱盐,溶于水发生双水解,虽然都是弱酸根离子,但水解程度还是有差异,根据平衡常数判断溶液的酸碱性,据此判断,反应NH4++HCO3-+H2O?NH3•H2O+H2CO3的平衡常数K,根据多重平衡规则推导计算.
解答 解:(1)根据题意,22gCO2通入750mL 1.0mol/L的NaOH溶液中充分反应,n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,n(NaOH)=1mol/L×0.75L=0.75mol,该反应既生成碳酸钠又生成碳酸氢钠,方程式为:2CO2+3NaOH═NaHCO3+Na2CO3+H2O,由0.5molCO2反应放出热量为xkJ,则2molCO2反应放出热量为4xkJ,即热化学反应方程式为:
2CO2(g)+3NaOH(aq)═NaHCO3 (aq)+Na2CO3(aq)+H2O(l)△H=-4xkJ/mol ①
在该条件下1molCO2通入到2L 1.0mol/L的NaOH溶液中充分反应,放出ykJ热量,则热化学方程式为2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-ykJ/mol ②
由盖斯定律①-②可得,NaOH(aq)+CO2(g)═NaHCO3(aq)△H=-(4x-y)kJ/mol,
故答案为:NaOH(aq)+CO2(g)═NaHCO3(aq)△H=-(4x-y)kJ/mol;
(2)①甲容器中,根据表中数据,0~40min内,NO的物质的量改变量为△n=2.00-1.50=0.50mol,反应经历的时间为△t=40min,容器体积V=1L,根据化学反应平均速率计算公式v(NO)=$\frac{△n}{V△t}$=$\frac{0.50mol}{1L×40min}$=0.0125mol/(L•min),
故答案为:0.0125mol/(L•min);
②甲和乙,起始物料相同,温度不同,从0~40min看,乙容器的化学反应速率比甲的快,温度升高能加快化学反应速率,因此乙容器的温度大于甲容器的温度,但乙容器中NO的转化率低于甲容器,因此升高温度,化学平衡向逆反应方向移动,则该反应的正反应是放热反应,焓变△H<0,
故选b;
③丙容器中NO的起始物质的量为1.00mol,丙容器与甲容器的温度相同,则两容器反应的平衡常数也相同,该反应为2NO(g)+C(s)?N2(g)+CO2(g),反应的平衡常数为K=$\frac{c({N}_{2})c(C{O}_{2})}{{c}^{2}(NO)}$,根据表中数据,平衡时,c(NO)=$\frac{0.80mol}{1L}$=0.80mol/L,C(N2)=$\frac{1}{2}×\frac{(2.00-0.80)mol}{1L}$=0.60mol/L,c(CO2)=c(N2)=0.60mol/L,则K=$\frac{0.60molL×0.60mol/L}{(0.80mol/L)^{2}}$=$\frac{9}{16}$,
设丙中NO的平衡转化率为α,则平衡时,c(NO)=(1-α)mol/L,C(N2)=$\frac{1}{2}$αmol/L,c(CO2)=c(N2)=$\frac{1}{2}$αmol/L,则K=$\frac{\frac{1}{2}αmol/L×\frac{1}{2}αmol/L}{(1-α)^{2}mo{l}^{2}/{L}^{2}}$=$\frac{9}{16}$,解得:α=0.60=60%,
事实上,这与甲容器的转化率是相同的,可以解释为等效平衡,反应2NO(g)+C(s)?N2(g)+CO2(g)是气体数守恒的反应,前后气体的物质的量总数不变,压强改变不影响化学移动,丙容器起始等效于对甲容器减压,减压不改变该反应的化学平衡,自然两个容器中的NO转化率就相同!准确的来说,知道这是等效平衡的,甚至不用这么多步骤计算,可以直接写答案.
故答案为:60%;
(3)NH4HCO3为弱酸弱碱盐,溶于水发生双水解,虽然都是弱酸根离子,但水解程度还是有差异,水解反应可以视作两个反应竞争,①NH4++H2O?NH3•H2O+H+,该反应的平衡常数为K1=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{H}_{4}^{+})}$=$\frac{{K}_{w}}{K(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-14}}{2×1{0}^{-5}}$=5×10-10,②HCO3-+H2O?H2CO3+OH-,该反应的平衡常数为K2=$\frac{c({H}_{2}C{O}_{3})c(O{H}^{-})}{c(HC{O}_{3}^{-})}$=$\frac{{K}_{w}}{{K}_{a2}({H}_{2}C{O}_{3})}$=$\frac{1{0}^{-14}}{4×1{0}^{-11}}$=2.5×10-4,显然K2>>K1,所以最终是以HCO3-的水解为主,则溶液中c(NH4+)>c(HCO3-),
反应NH4++HCO3-+H2O?NH3•H2O+H2CO3的平衡常数K,根据多重平衡规则,K=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}_{2}C{O}_{3})}{c(N{H}_{4}^{+})c(HC{O}_{3}^{-})}$=$\frac{{K}_{w}}{{K}_{a1}({H}_{2}C{O}_{3}){K}_{b}(N{H}_{3}•{H}_{2}O)}$=1.25×10-3,
故答案为:>;1.25×10-3.
点评 本题考查化学原理部分知识,包含热化学方程式的书写,盖斯定律,化学反应速率的计算,化学平衡的移动,盐类水解,平衡常数的简单应用.注意等效平衡法给解题带来的方便.本题考查的知识点较多,题目难度中等,是中档题.


科目:高中化学 来源: 题型:选择题
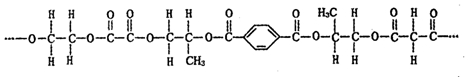
| A. | 该高分子由4种单体(聚合成髙分子的简单小分子)缩聚而成 | |
| B. | 构成该分子的几种竣酸单体互为同系物 | |
| C. | 上述单体中的乙二醇,可被02催化氧化生成单体之一的草酸 | |
| D. | 该高分子有固定熔沸点,1 mol上述链节完全水解需要氢氧化钠物质的量为 5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| |||||
| B. |
| |||||
| C. |
| |||||
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应 | △H(kJ•mol-1) | 平衡常数K |
| ①4NH3(g)+5O2(g)?4NO(g)+6H2O(g) | -907 | 1.1×1026 |
| ②4NH3(g)+4O2(g)?2N2O(g)+6H2O(g) | -1105 | 4.4×1028 |
| ③4NH3(g)+3O2(g)?2N2 (g)+6H2O(g) | -1269 | 7.1×1034 |
| A. | N2(g)+O2(g)=2NO(g)△H=362 kJ•mol-1 | |
| B. | 增大压强,则反应②的K 不变,反应①和③的K 减小 | |
| C. | 500℃,2N2O(g)+O2(g)?4 NO(g) K=4×102 | |
| D. | 使用合适的催化剂可提高反应的选择性,提高NO 的产出率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 其中的离子交换膜需选用阴离子交换膜 | |
| B. | 阴极的电极反应式为:2HSO3-+2e-=S2O42-+2OH- | |
| C. | 阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 反应一段时间后将惰性电极换成铁电极,对电极产物不产生影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:2:2 | B. | 5:5:5:4 | C. | 5:5:4:4 | D. | 7:7:4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤⑥ | C. | ②④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蚕食被中含有的蚕丝 | B. | 大豆油、猪油中含有的油脂 | ||
| C. | 五谷杂粮中含有的淀粉 | D. | 棉质衣服中的纤维素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com