
 氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.
氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用.| T/K | 398 | 498 |
| 平衡常数K | K1 | K2 |
分析 (1)根据n=cV计算生成氨气物质的量,再根据方程式计算消耗氮气的物质的量,而计算氮气的转化率;
(2)由图可知,1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)放出热量为368kJ-134kJ=234kJ,注明物质的聚集状态与反应热书写热化学方程式;
(3)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
②正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
③已知:Ⅰ.2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol
Ⅱ.N2(g)+2O2(g)═2NO2 (g)△H=+67.8kJ/mol
Ⅲ.N2(g)+3H2(g)═2NH3 (g)△H=-92.0kJ/mol
根据盖斯定律,(Ⅱ-Ⅲ+Ⅰ×$\frac{3}{2}$)÷2可得:NH3(g)+$\frac{7}{4}$O2(g)═NO2(g)+$\frac{3}{2}$H2O(l);
(4)1mol醋酸反应时放出热量为10a kJ,醋酸与一水合氨反应生成醋酸铵与水,醋酸、一水合氨为溶液,生成醋酸铵完全电离,据此书写热化学方程式.
解答 解:(1)生成氨气物质的量为0.4mol/L×2L=0.8mol,由方程式可知消耗氮气为0.8mol×$\frac{1}{2}$=0.4mol,故氮气的转化率为$\frac{0.4mol}{2mol}$×100%=20%,故答案为:20%;
(2)由图可知,1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)放出热量为368kJ-134kJ=234kJ,热化学方程式为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234KJ/mol;
(3)①N2(g)+3H2(g)?2NH3(g)的化学平衡常数表达式K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$,
故答案为:$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$;
②正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故平衡常数K1>K2,
故答案为:>;
③已知:Ⅰ.2H2(g)+O2(g)═2H2O(l)△H=-483.6kJ/mol
Ⅱ.N2(g)+2O2(g)═2NO2 (g)△H=+67.8kJ/mol
Ⅲ.N2(g)+3H2(g)═2NH3 (g)△H=-92.0kJ/mol
根据盖斯定律,(Ⅱ-Ⅲ+Ⅰ×$\frac{3}{2}$)÷2可得:NH3(g)+$\frac{7}{4}$O2(g)═NO2(g)+$\frac{3}{2}$H2O(l) 则△H=
[67.8kJ/mol-(-92.0kJ/mol )+(-483.6kJ/mol )×$\frac{3}{2}$]=-282.8kJ/mol,故NH3 (g)的燃烧热282.8kJ/mol.
故答案为:282.8;
(4)醋酸、一水合氨的物质的量均为1L×0.1mol/L=0.1mol,二者恰好完全反应生成醋酸铵与水,1mol醋酸反应时放出热量为akJ×$\frac{1mol}{0.1mol}$=10a kJ,故热化学方程式为:CH3COOH(aq)+NH3•H2O(aq)=CH3COO-(aq )+NH4+ (aq )+H2O(l)△H=-10akJ/mol,
故答案为:CH3COOH(aq)+NH3•H2O(aq)=CH3COO-(aq )+NH4+ (aq )+H2O(l)△H=-10akJ/mol.
点评 本题考查化学平衡计算、平衡常数及影响因素、热化学方程式书写、盖斯定律应用等,(4)中注意物质聚集状态,难度中等.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LCCl4含有NA个CCl4分子 | |
| B. | 27g铝被完全氧化成氧化铝,失去2NA个电子 | |
| C. | 在标准状况下,1molNH3和CO混合气体所占的体积约为22.4L | |
| D. | 常温常压下,28g乙烯含有2NA个碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池在碱性介质中负极的反应式是:O2+2H2O+4e-═4OH- | |
| B. | NaHCO3在水溶液中的水解离子方程式:HCO${\;}_{3}^{-}$+H2O═CO2↑+OH- | |
| C. | 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)═HgS(s)+Fe2+(aq) | |
| D. | 将Na2CO3在水溶液加热蒸干,由于CO2易挥发,最终得到NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 反应方向 |
| (1) | 0.0600 | 0.400 | 2.000 | |
| (2) | 0.0960 | 0.300 | 0.500 | |
| (3) | 0.0862 | 0.263 | 1.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
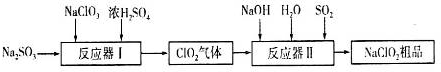
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液 | |
| B. | 制取二氧化氮时,用水或NaOH溶液吸收尾气 | |
| C. | 为测定Na2CO3和NaHCO3混合物中Na2CO3质量分数,取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重bg,该方案可行 | |
| D. | 为测定镀锌铁皮的锌层厚度,将镀锌铁皮与足量盐酸反应待气泡明显减少时取出,洗涤,烘干,称重.若烘干时间过长,会导致测定结果偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H3O++CO32- | B. | NH3+H2O?NH4++OH- | ||
| C. | CO32-+2H2O?H2CO3+2OH- | D. | Al3++3H2O?Al(OH)3+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以地沟油为原料加工制成的生物柴油的成分与从石油分馏得到的柴油成分不同 | |
| B. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和二次能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com