
某恒温密闭容器中,可逆反应A(s) B + C(g) -Q,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
B + C(g) -Q,达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)生成=1﹕1
C.保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动
D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源:2015届福建省四地六校高二下学期第一次月考化学试卷(解析版) 题型:选择题
根据元素周期律和物质结构的有关知识,以下有关排序错误的是( )
A、离子半径:S2->Cl->Ca2+ B、原子半径:Ca>S>Cl
C、酸性:HClO4<HBrO4<HIO4 D、热稳定性:HCl>H2S>H2Se
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
已知乙炔(C2H2)、苯(C6H6)、乙醛(C2H4O)的混合气体中含氧元素的质量分数为8%,则
混合气体中碳元素的质量分数为
A.60% B.84% C.91% D.412%
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高二上学期期末考试化学试卷(解析版) 题型:选择题
实验:①0.1mol·L-1AgNO3溶液和0.1mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到
滤液b和白色沉淀c;②向滤液b中滴加0.1mol·L-1KI溶液,出现浑浊;③向沉淀c中滴加0.1mol·L-1KI溶液,沉淀变为黄色。下列分析不正确的是:
A.浊液a中存在沉淀溶解平衡:AgCl(g)  Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
B.滤液b中不含有Ag+
C.③中颜色变化说明AgCl转化为AgI
D.实验可以证明AgI比AgCl更难溶
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:填空题
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0)
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变)。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。

(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达)。
(5)10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量。
(6)能说明该反应已经达到平衡状态的是( )
a. v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.恒容容器内物质的密度保持不变
(7)为使该反应的反应速率增大,且平衡向正反应方向移动的是( )
a.及时分离出SO3气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末质量检测化学试卷(解析版) 题型:选择题
锂离子电池已经成为应用最广泛的可充电电池。某种锂离子电池的结构示意图如图,其中两极区间的隔膜只允许Li+通过。电池充电时的总反应化学方程式为:LiCoO2 = Li1-xCoO2+xLi。关于该电池的推论错误的是

A.放电时,Li+主要从负极区通过隔膜移向正极区
B.放电时,负极反应xLi-xe-= xLi+
C.充电时,有电能转化为化学能
D.充电时,负极(C)上锂元素被氧化
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆门市高二上学期期末考试化学试卷(解析版) 题型:填空题
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(g)(△H<0)
(1)写出该反应的化学平衡常数表达式K=
(2)降低温度,该反应K值 ,二氧化硫转化率 ,化学反应速率 (以上均填增大、减小或不变)。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。

(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达)。
(5)10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量。
(6)能说明该反应已经达到平衡状态的是( )
a. v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.恒容容器内物质的密度保持不变
(7)为使该反应的反应速率增大,且平衡向正反应方向移动的是( )
a.及时分离出SO3气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源:2015届湖北省荆州市部分县市高二上学期期末考试化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是
A.水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kh表示),Na2CO3第一步水解反应的水解常数的表示式 Kh≤
B.HS-电离的离子方程式:HS-+H2O H3O++S2-
H3O++S2-
C.N2(g)+3H2(g) 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小
2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小
D.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为:
CO(g)+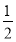 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com