
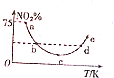
 取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )
取5等份(各1mol)NO2,分别加入温度不同的2L恒容密闭容器中,发生反应:2NO2(g)?N2O4(g)△H<0.反应10s时,分别测定体系中NO2的百分含量(NO2%),并作出其随反应温度(T)变化的关系图,据图分析,下列说法正确的是( )| A. | 10s内,图中a点对应的N2O4反应速率为0.01mol•L-1•s-1 | |
| B. | 图中b、d两点对应的NO2速率相等 | |
| C. | c点前后平衡移动的方向相反 | |
| D. | e点对应的容器中气体颜色最深 |
分析 A.a点NO2的百分含量75%,结合化学三行计算列式计算,反应速率V=$\frac{△c}{△t}$;
B.bd点反应温度不同,反应速率不同;
C.c点前二氧化氮含量减小,反应正向进行,c点随温度升高,二氧化氮含量增大,说明平衡逆向进行;
D.e点二氧化氮浓度不是最大,最大点为a点.
解答 解:A.a点NO2的百分含量75%,设二氧化氮消耗物质的量为x,
2NO2(g)?N2O4(g)
起始量(mol) 1 0
变化量(mol) x 0.5x
10s末(mol) 1-x 0.5x
$\frac{1-x}{1-x+0.5x}$=75%
x=0.4mol
二氧化氮反应速率=$\frac{\frac{0.4mol}{2L}}{10s}$=0.02mol/L•s,速率之比等于化学方程式计量数之比,N2O4反应速率为0.01mol•L-1•s-1,故A正确;
B.bd点二氧化氮含量相同,但反应温度不同,反应速率不同,故B错误;
C.c点前二氧化氮含量减小,反应正向进行,c点随温度升高,二氧化氮含量增大,说明平衡逆向进行,c点前未达到平衡状态,故C错误;
D.二氧化氮是红棕色气体,四氧化二氮气体为无色气体,浓度越大颜色越深,所以a点对应的容器中气体颜色最深,故D错误;
故选A.
点评 本题考查了图象变化分析,化学反应速率、化学平衡的计算和影响因素分析,主要是反应特征和化学平衡移动原理的理解应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 向HNO2溶液中加入NaNO2固体,pH变大 | |
| B. | 用HNO2溶液做导电性实验,灯泡很暗 | |
| C. | 0.1mol•L-1的HNO2溶液的pH=2 | |
| D. | pH=3的HNO2溶液稀释至100倍后,3<pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 | |
| B. | 酸碱中和滴定时,锥形瓶需用待测液润洗2~3次,再加入待测液 | |
| C. | 将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深 | |
| D. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 7:8 | C. | 8:7 | D. | 5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
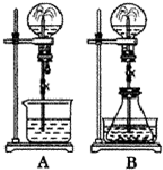 喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题:
喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com