

分析 (1)根据实验目的,②为制取二氧化碳装置,实验室中常用碳酸钙与盐酸反应,二氧化碳中混有氯化氢,需要用装置④除去,然后用装置③干燥,然后在①中进行钠与二氧化碳的反应,然后用⑤检验反应产物,据此进行连接装置;
(2)所选试剂的作用是增大溶液体积,可以用稀硝酸,加入H2SO4溶液后生成硫酸钙微溶,会阻止反应进一步进行,由于四氯化碳的密度大于盐酸,也可以加入四氯化碳溶液,但是苯的密度小于盐酸,加入苯不能使稀盐酸与碳酸钙接触;
(3)二氧化碳与澄清石灰水反应生成碳酸钙沉淀,当装置⑤中澄清石灰水变浑浊说明装置中空气已经排净;原因是空气中的二氧化碳、水与钠反应,需要排净空气,避免干扰实验;
(4)根据氧化钠与二氧化碳反应生成碳酸钠分析;
Ⅰ.根据题干信息及反应现象判断反应物、生成物,然后写出反应的化学方程式;
Ⅱ.根据n=$\frac{m}{M}$计算出钠的物质的量,再根据n=$\frac{V}{22.4L/mol}$计算出标况下224mL二氧化碳的物质的量,从而得出反应后生成碳酸钠的物质的量;溶液中还有固体残留,该固体只能为C,说明钠与二氧化碳反应生成碳酸钠和C,据此写出反应的化学方程式.
解答 解:(1)探究钠与CO2的反应,首先用盐酸和碳酸钙在②中反应制取二氧化碳气体,制取的二氧化碳中混有挥发出来的HCl,需要用装置④中的饱和碳酸氢钠溶液除去HCl,然后用③浓硫酸干燥,再在①中进行钠与二氧化碳的反应,最后用装置⑤检验反应产物,所以装置的连接顺序为:g、d、e、a(b)、b(a)、h,
故答案为:g、d、e、a(b)、b(a)、h;
(2)A.H2SO4溶液:加入H2SO4溶液后生成硫酸钙微溶,会阻止反应进一步进行,故A错误;
B.CCl4:四氯化碳的密度大于稀盐酸,加入四氯化碳后会,四氯化碳层在混合液下层,从而使盐酸与碳酸钙接触,故B正确;
C.苯:苯的密度小于盐酸,加入苯后,苯在混合液上层,无法使稀盐酸与碳酸钙接触,故C错误;
D.稀硝酸:加入稀硝酸后,可以增大溶液体积,使溶液与碳酸钙接触,故D正确;
故答案为:BD;
(3)钠化学性质比较活泼,能够与空气中的氧气、水反应,所以点燃酒精灯之前应需要打开弹簧夹,让CO2充满整个装置,以便排尽装置中的空气,避免空气中O2、H2O干扰实验;当装置装置⑤中澄清石灰水变浑浊时,证明装置中空气已经排净,
故答案为:装置⑤中澄清石灰水开始变浑浊;
(4)因为氧化钠与二氧化碳反应生成碳酸钠,所以反应过程中CO2足量,探究钠与CO2充分反应不可能生成氧化钠固体,故①②可能,③④不可能;故答案为:①②;
Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,PdCl2能被CO还原得到黑色的Pd,则黑色沉淀为Pd,钠与二氧化碳反应生成了CO;装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体,该气体为二氧化碳,则钠与二氧化碳反应生成碳酸钠和CO,2Na+2CO2$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO,
故答案为:2Na+2CO2$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO;
Ⅱ.装置①中钠的质量为0.46g,钠的物质的量为:n(Na)=$\frac{0.46g}{23g/mol}$=0.02mol,
将装置①中的固体加入到足量稀盐酸中产生224mL(标准状况)CO2气体,二氧化碳的物质的量为:n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,则反应后生成碳酸钠的物质的量为0.01mol,说明钠完全转化成了碳酸钠;
溶液中还有固体残留,根据化合价变化可知,残留的固体只能为C,则钠与二氧化碳反应生成了碳酸钠和C,反应的化学方程式为:4Na+3CO2$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+C,
故答案为:4Na+3CO2$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+C.
点评 本题通过探究钠与CO2的反应,考查了性质实验方案的设计原则,题目难度中等,正确理解题干信息为解答关键,注意掌握性质实验方案的设计原则,(4)为易错点,需要根据题中信息及反应现象判断反应物、生成物,试题充分考查了学生的分析、理解能力及综合应用所学知识的能力.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:解答题
| 醋酸浓度/mol•L-1 | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO${\;}_{3}^{-}$、NH${\;}_{4}^{+}$ | NaHSO4溶液 | 3Fe${\;}^{2{+}_{\;}^{\;}}$+NO${\;}_{3}^{-}$+4H+═3Fe3++NO↑+2H2O |
| B | Ca2+、HCO${\;}_{3}^{-}$、Cl- | 少量NaOH溶液 | Ca2++2HCO${\;}_{3}^{-}$+2OH-═2H2O+CaCO3↓+CO${\;}_{3}^{2-}$ |
| C | K+、AlO${\;}_{2}^{-}$、HCO${\;}_{3}^{-}$ | 通入少量CO2 | 2AlO${\;}_{2}^{-}$+3H2O+CO2═2Al(OH)3↓+CO${\;}_{3}^{2-}$ |
| D | NH${\;}_{4}^{+}$、Al3+、SO${\;}_{4}^{2-}$ | 少量Ba(OH)2溶液 | 2NH${\;}_{4}^{+}$+SO${\;}_{4}^{2-}$+Ba2++2OH-═BaSO4↓+2NH3.H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
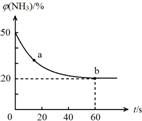 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加A的物质的量 | B. | 升高体系温度 | ||
| C. | 增加体系压强 | D. | 减少C的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
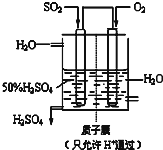 工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作:
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作: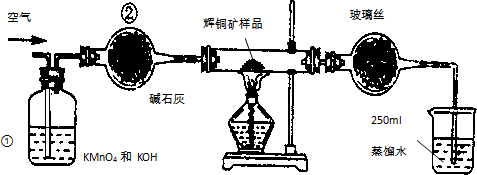
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com