
【题目】下列生产生活等实际应用中,不能用勒夏特列原理解释的是( )
A. 新制氯水中存在平衡Cl2+H2O ![]() HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
HCl+ HClO,当加入AgNO3溶液后溶液颜色变浅
B. 使用更有效的催化剂,提高可逆反应的转化率
C. 工业合成NH3是放热反应,为提高NH3的产率,理论上应采取低温的措施
D. 工业生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率(2SO2+O2![]() 2SO3)
2SO3)
【答案】B
【解析】
勒夏特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡将向能够减弱这种改变的方向移动。勒夏特列原理适用的对象应存在可逆过程,若与可逆过程无关,与平衡移动无关,则不能用勒夏特列原理解释,据此分析解答。
A.氯水中存在平衡:Cl2+H2O![]() HCl+HClO,当加入AgNO3溶液后,生成氯化银沉淀,溶液中氯离子浓度降低,平衡向右移动,氯气的浓度减小,溶液颜色变浅,可以用勒夏特列原理解释,不符合题意;
HCl+HClO,当加入AgNO3溶液后,生成氯化银沉淀,溶液中氯离子浓度降低,平衡向右移动,氯气的浓度减小,溶液颜色变浅,可以用勒夏特列原理解释,不符合题意;
B.由于催化剂不影响化学平衡,不能用勒夏特列原理解释,符合题意;
C.合成氨反应是放热的反应,降低温度,会促使平衡正向移动,可以提高氨的产率,能用勒夏特列原理解释,不符合题意;
D.通入过量空气,增加了氧气的浓度,促进平衡正向移动,二氧化硫的转化率将会增大,能用勒夏特列原理解释,不符合题意;综上所述,答案为B。


科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列热化学方程式正确的是( )

A. N2(g)+3H2(g)===2NH3(g) ΔH=-(b-a) kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g) ΔH=-(a-b) kJ·mol-1
C. 2NH3(l)===N2(g)+3H2(g) ΔH=2(a+b-c) kJ·mol-1
D. 2NH3(l)===N2(g)+3H2(g) ΔH=2(b+c-a) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜阳极泥(主要含有铜、银、金、少量的镍)是有色金属治炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下

已知:分金液的主要成分为[AuCl4]—;分金渣的主要成分为AgCl;分银液中主要成分为Ag(SO3)2]3—,且存在[Ag(SO3)2]3—![]() Ag++2SO32—
Ag++2SO32—
(1)“分铜”时,单质铜发生反应的化学方程式为_______________________。已知“分铜”时各元素的浸出率如下表所示。
Cu | Au | Ag | Ni | |
浸出率% | 85.7 | 0 | 4.5 | 93.5 |
“分铜”时加入足量的NaC1的主要作用为_________________________________。
(2)“分金”时,单质金发生反应的离子方程式为__________________________。
(3)某小组模拟工业上回收分银渣中的银,过程如下:

中主要反应:AgCl+2SO32—![]() Ag(SO3)23—+C1—
Ag(SO3)23—+C1—
①研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是____________________。
②将Ⅱ中反应的离子方程式补充完整:
_____Ag(SO3)23-+_____OH—+_____==_____+_____SO32—+_____+CO32—
③中回收液可直接循环使用,但循环多次后,银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:________________________________________。
(4)工业上,粗银电解精炼时,电解质溶液的pH为1.5~2,电流为5~10A,若用7A的电流电解60min后,得到21.6gAg,则该电解池的电解效率为________%。(保留小数点后位。通过一定电荷量时阴极上实际沉积的金属质量与理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C·mol—1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,可以证明反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1个N≡N键断裂的同时有3个H—H键形成
②N2、H2、NH3的分子数之比为1∶3∶2
③1个N≡N键断裂的同时有6个N—H键形成
④N2、H2、NH3的浓度不再变化
A. ①④ B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.运用烤蓝技术,在钢铁表面形成一层致密的氧化物薄膜
B.古代有“曾青得铁则化为铜”是现代“湿法炼铜”的先驱,它利用了铁置换出铜的原理
C.FeCl3溶液可用于铜质线路板制作,利用了FeCl3能从含有Cu2+的溶液中置换出铜
D.常温下,铁遇浓硝酸发生钝化,所以可用铁质容器盛放浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室在配制Cu(NO3)2的溶液时,常将Cu(NO3)2固体先溶于较浓的硝酸中,再用蒸馏水稀释到所需的浓度,其目的是_________
(2)FeCl3净水的原理是(用离子方程式表示)_________将AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是______(写化学式)
(3)已知草酸是二元弱酸,常温下测得0.1mol/L的KHC2O4的pH为4.8,则此KHC2O4溶液中c(C2O42-)____c(H2C2O4) (填“大于”或“小于”或“等于”)
(4)泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈现碱性的原因是(用离子方程式表示)______ ;灭火器内另一容器中装有Al2(SO4)3溶液,该溶液呈酸性的原因是(用离子方程式表示)_______,当意外失火时,使泡沫灭火器倒过来摇动即可使药液混合,喷出大量的白色泡沫,阻止火势蔓延,其相关的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液滴加到已二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )。

A. 常温下Ka1(H2X)的值约为10-4.4
B. 曲线N表示pH与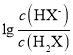
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是( )
A.气态氢化物的稳定性:HCl>HI
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si

D.用中文“![]() ”
”![]() 命名的第118号元素在周期表中位于第七周期
命名的第118号元素在周期表中位于第七周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镍蓄电池又称爱迪生电池,放电时总反应为Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A. 电池的电解质溶液为碱性溶液,阳离子向正极移动
B. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O
C. 电池充电过程中,阴极附近溶液的pH降低
D. 电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com