
【题目】取一小块金属钠,放在燃烧匙里加热,下列实验现象描述正确的是:①金属先熔化;②在空气中燃烧,放出黄色火花;③燃烧后得白色固体;④燃烧时火焰为黄色;⑤燃烧后生成浅黄色固体物质 ( )
A.①② B.①②③ C.①④⑤ D.④⑤
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I、将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g) +B(g)![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s 内正反应的化学反应速率为___________________;
(2)反应前A的物质的量浓度是___________________________;
Ⅱ、某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) 反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为___________。
2SO3(g) 反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为___________。
III、已知在容积固定的密闭容器中充入NH3和O2发生如下反应:
4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
下列能说明该反应已经达到平衡状态的是___________;
A.容器中气体总质量不变 B.c(O2)不变 C.v (O2)=1.25 v(NH3)
D.体系压强不变 E.相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
Ⅳ、在一定条件下,可实现如图所示物质之间的变化:

(1)已知孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。
则图中的F是____________(填化学式)。
(2)写出明矾[KAl(SO4)2·12H2O] 与过量NaOH溶液反应的离子方程式:
_____________________________________________。
(3)图中所得C和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式:
________________________________________________。
Ⅴ、海带提碘的流程如下:

(1)第②步为了加快溶解速率并使充分进入溶液中,可以采取的措施是:
______________________、______________________(写出两条)。
(2)写出第④步发生反应的离子方式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,把一个盛有一定量甲烷和氯气的密闭容器放在光亮的地方,两种气体发生反应,下列叙述不正确的是
A. 容器内原子总数不变 B. 容器内分子总数不变
C. 容器内压强不变 D. 容器内壁出现油状液滴,且气体颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.碳酸钙与盐酸反应:CO32-+H+=H2O+CO2
B.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
C.硝酸与氢氧化钡反应:OH-+H+=H2O
D.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化尿素[CO(NH2)2·H2O2]是一种白色粉末,溶于水形成的溶液呈弱酸性。过氧化尿素不稳定,在痕量重金属离子等活性催化剂的存在下迅速分解。工业生产过氧化尿素的原理和流程如下。
原理:CO(NH2)2+H2O2 ![]() CO(NH2)2·H2O2
CO(NH2)2·H2O2
流程:
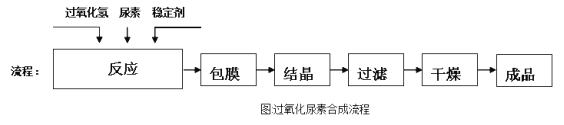
回答下列问题:
(l)已知过氧化尿素[CO(NH2)2·H2O2]中的CO(NH2)2与H2O2以氢键连接,其中碳元素的化合价是___________。(填序号)
A. +2价 B. -l价 C. 0价 D. +4价
(2)过氧化尿素鉴定反应:在重铬酸钾酸性溶液中加入乙醚和少许过氧化尿素,振荡。上层乙醚呈蓝色,这是由于在酸性溶液中过氧化尿素中的过氧化氢与重铬酸钾反应生成较稳定的蓝色过氧化铬(CrO5)。写出H2O2与重铬酸钾反应的离子方程式__________。
(3)经过上述化学工艺后的产品是粗产品。已知30℃时尿素的溶解度远大于过氧化尿素的溶解度,则提纯粗产品的操作顺序是___________ (填序号)。
①冷却至30℃结晶 ②过滤 ③蒸发浓缩 ④溶解 ⑤洗涤
(4)在实验室中采用上述原理制取过氧化尿素,搅拌器的材质一般用玻璃而非铁质,原因是___。
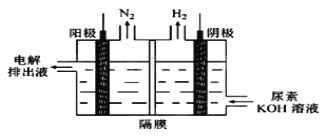
(5)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为________。
(6)Ⅰ.为测定产品中H2O2的含量,常用KMnO4溶液滴定H2O2,高锰酸钾标准溶液通常放置时间较长,因此在滴定H2O2前,常用现配的草酸钠溶液先标定出KMnO4标准溶液的浓度。
Ⅱ.称取过氧化尿素样品4.000g ,溶解在250mL容量瓶中定容。准确量取25.00mL于锥形瓶中,加入1.00mL 6mo1/L的硫酸,用标定过的0.2000mol/L的高锰酸钾标准溶液滴定至滴入最后一滴时溶液显浅红色且半分钟内不褪色,三次滴定平均消耗KMnO4标准溶液10.00mL,(KMnO4与尿素不反应)。
①H2O2的质量分数是_______ (精确至0.1%)。
②若装草酸钠溶液的滴定管水洗后未润洗,最终H2O2的质量分数______ (填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜的配合物A结构如图图1。请回答下列问题:
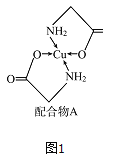
(1)写出基态Cu的外围电子排布式________
(2)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和x键数目之比是___;N2O与CO2互为等电子体,则N2O的电子式为_______。
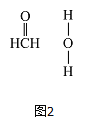
(3)在Cu催化下,甲醇可被氧化为甲醛,甲醇分子中HCO的键角____(选填“大于”、“等于”或“小于”) l20°;甲醛能与水形成氢健,请在如图2中表示出来____。
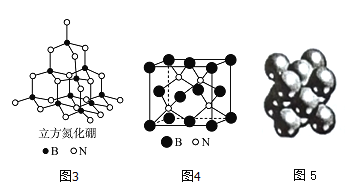
(4)立方氮化硼如图3、图4与金刚石结构相似,是超硬材料。立方氮化硼晶体内B一N键数与硼原子数之比为__________;
(5)Cu晶体的堆积方式如图5所示,设Cu原子半径为a,晶体中Cu原子的配位数为_____,晶体的空间利用率为_________。(已知:![]() ,列式并计算出结果)
,列式并计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是:
A.钠在空气燃烧时先熔化,再燃烧,最后所得的产物是Na2O2
B.铝因在空气中形成了一薄层致密的氧化膜,保护内层金属,故铝不需特殊保护
C.铝制品在生活中非常普通,是因为铝非常不活泼
D.铁因在潮湿的空气中形成的氧化物疏松,不能保护内层金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
![]()
(1)步骤I,CO变换反应的能量变化如下图所示:

①CO变换反应的热化学方程式是________________。
②一定条件下,向体积固定的密闭容器中充入aL半水煤气,发生CO变换反应。测得不同温度(T1,T2)氢气的体积分数ψ(H2)与时间的关系如下所示。
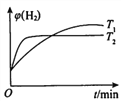
i.T1、T2的大小关系及判断理由是______________。
ii.请在上图中画出:其他条件相同时,起始充入0.5aL半水煤气,T2温度下氢气的体积分数ψ( H2)随时间的变化曲线。______________
(2)步骤Ⅱ,用饱和Na2CO3溶液作吸收剂脱除CO2时,初期无明显现象,后期有固体析出。
①溶液中离子浓度关系正确的是__________(选填字母)。
a.吸收前:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.吸收初期:2c(CO32-)+2 c(HCO3-)+2c(H2CO3)=c(Na+)
c.吸收全进程:c(Na+)+c( H+)=2c(CO32-)+ c(HCO3-)+ c(OH-)
②后期析出固体的成分及析出固体的原因是___________。
③当吸收剂失效时,请写出一种可使其再生的方法(用化学方程式表示):____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】每年的6月26日是国际禁毒日,珍爱生命,远离毒品。以下是四种毒品的结构简式,下列有关说法正确的是
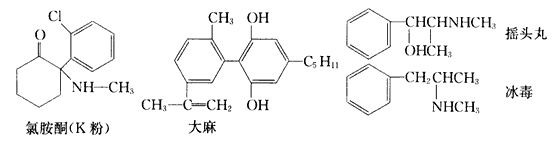
A. 四种毒品中都含有苯环,都属于芳香烃
B. 氯胺酮分子中所有碳原子可能共平面
C. 1 mol大麻与溴水反应最多消耗3molBr2
D. 摇头丸经过消去反应可制取冰毒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com