

分析 (1)能与Fe2O3、CuO、C物质反应产生两种气体的浓酸不可能是浓盐酸;如果是浓硫酸,可以与C单质发生氧化还原反应,浓硫酸被还原为SO2,C被氧化为CO2,如果是浓硝酸,则两种气体是CO2和NO2,其变化与加浓硫酸的反应相同.无论是那种浓酸均可以使两种氧化物Fe2O3、CuO转化为对应的盐,盐溶液加入过量的铁粉,可以得到红色的固体,即为铜,据此圈定含有的物质;
(2)浓酸若为浓硫酸,其与样品中的C反应生成CO2和SO2,通入NaHCO3溶液后SO2被吸收,剩余CO2;
(3)X溶液中加过量Fe粉,得Y溶液和两种固体(其中一种固体为红色的Cu,另一种为过量的Fe粉),这个过程发生了置换反应:Cu2++Fe═Cu+Fe2+;再向Y溶液中通入过量Cl2,则会发生反应:Cl2+2Fe2+═2Cl-+2Fe3+、2Fe3++Cu═2Fe2++Cu2+、Cl2+H2O=HCl+HClO.
解答 解:(1)与Fe2O3、Fe、CuO、C、Al物质反应产生两种气体的浓酸不可能是浓盐酸;如果是浓硫酸,可以与Fe、C、Al单质发生氧化还原反应,浓硫酸被还原为SO2,C被氧化为CO2,Fe和Al被氧化为Fe3+和Al3+;如果是浓硝酸,则两种气体是CO2和NO2,其变化与加浓硫酸的反应相同.无论是那种浓酸均可以使两种氧化物Fe2O3、CuO转化为对应的盐,盐溶液加入过量的铁粉,可以得到红色的固体,即为铜,据此得到该样品中一定存在C,CuO,故答案为:C,CuO;
(2)浓酸若为浓硫酸,其与样品中的C反应生成CO2和SO2,通入NaHCO3溶液后SO2被吸收,剩余CO2,反应I中能同时生成两种气体的化学方程式是:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(3)向溶液X中加过量Fe粉,得Y溶液和两种固体,且一种固体为红色(Cu),另一种就是过量的Fe粉,这个过程发生了置换反应:Cu2++Fe=Cu+Fe2+,向Y溶液中通入过量氯气,并不断搅拌,会发生如下反应:Cl2+2Fe2+=2Cl-+2Fe3+,2Fe3++Cu=2Fe2++Cu2+,Cl2+H2O=HCl+HClO,充分反应后,溶液中的阳离子是:Cu2+、Fe3+、H+(特别注意没有了Fe2+),
故答案为:Cu2+、Fe3+、H+.
点评 本题考查无机推断,主要涉及金属单质、金属氧化物、非金属单质的性质,题目综合性强,涉及知识面广,难度中等,注意掌握浓硫酸、浓硝酸的性质.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:3 | C. | 3:4 | D. | 4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 生成白色沉淀 |
| ② | A+C | 放出无色气体 |
| ③ | A+D | 放出无色气体 |
| ④ | B+C | 无明显变化 |
| ⑤ | B+D | 生成白色沉淀 |
| ⑥ | C+D | 无明显变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
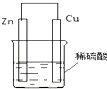 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com