
 Al(OH)3(胶体) + 3HCl(aq) ΔH =+400Q kJ∕mol.
Al(OH)3(胶体) + 3HCl(aq) ΔH =+400Q kJ∕mol. Al(OH)3(胶体) + 3HCl(aq) ΔH =+400Q kJ∕mol.
Al(OH)3(胶体) + 3HCl(aq) ΔH =+400Q kJ∕mol.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显血红色。再向溶液中加入几滴新制的氯水,溶液变为血红色 | 该溶液中一定含有Fe2+ |
| C | 某气体能使湿润的蓝色石蕊试纸变红 | 该气体水溶液一定显碱性 |
| D | 将少量某有机物滴加到新制氢氧化铜悬浊液中,充分振荡,未见砖红色沉淀生成 | 该有机物不含醛基 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 操作 |
| A | 检验淀粉水解产物有还原性 | 淀粉溶液和稀H2SO4混合加热,冷却后,再加新制的Cu(OH)2悬浊液加热至沸腾 |
| B | 证明SO2具有漂白性 | 将SO2通入溴水中 |
| C | 为了提取溴水中的溴 | 加入植物油进行萃取 |
| D | 浓、稀HNO3分别与Cu反应 | 比较浓、稀HNO3的氧化性强弱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 金属 离子 | 开始沉淀 的pH | 沉淀完全 的pH |
| Fe3+ | 1. 1 | 3. 2 |
| Al3+ | 3. 0 | 5. 0 |
| Fe2+ | 5. 8 | 8. 8 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
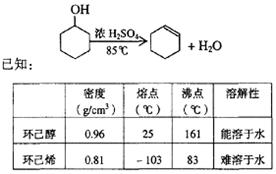
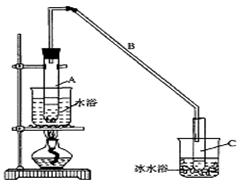
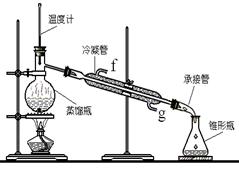
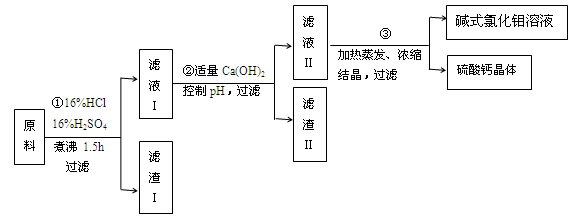
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.盐酸 | B.Na2CO3溶液 |
| C.氯水 | D.FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定没有N2,CO和HCl中至少有一种 |
| B.一定没有N2,CO和HCl都有 |
| C.一定有N2,CO和HCl中至少有一种 |
| D.一定有N2和HCl,肯定没有CO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | A | B | C | D |
| 实验 目的 | 除去KCl中少量MnO2 | 用10 mol·L-1盐酸配制100 mL 0.1 mol·L-1盐酸 | 用含有少量NH4Cl杂质的NaCl溶液制备氯化钠晶体 | 除去乙烯中少量SO2 |
| 实验仪器或装置 | 烧杯、玻璃棒、分液漏斗 | 100 mL容量瓶、玻璃棒、烧杯 | 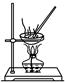 | 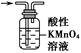 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com