
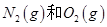 反应生成
反应生成 过程中的能量变化,下列说法正确的是
过程中的能量变化,下列说法正确的是
A.通常情况下,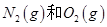 混合能直接生成NO 混合能直接生成NO |
B.1mol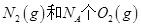 反应放出的能量为180kJ 反应放出的能量为180kJ |
| C.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
D.1mol 具有的总能量小于2mol 具有的总能量小于2mol  具有的总能量 具有的总能量 |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:不详 题型:单选题

| A.X原子可能为第ⅤA族元素 |
| B.Y原子一定为第ⅠA族元素 |
| C.该分子中,既含极性键,又含非极性键 |
| D.从圆球的大小分析,该分子可能为N2F4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol
O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ/mol| A.1 mol CH3OH完全燃烧放出热量192.9 kJ |
B.②中的能量变化如图所示,则Q=E3-E1 |
| C.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收热量 |
| D.根据②推知:在25 ℃,101 kPa时,1 mol CH3OH(g)完全燃烧生成CO2和H2O放出的热量应大于192.9 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| B.1 mol S完全燃烧放热297.3 kJ,其热化学方程式:S+O2=SO2 ΔH=-297.3 kJ·mol-1 |
| C.1 mol H2SO4与1 mol Ba(OH)2反应生成1 mol BaSO4沉淀时放出的热量叫做中和热 |
| D.反应热的大小与反应物所具有的能量和生成物所具有的能量无关 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.在100 ℃、101 kPa条件下,1mol液态水气化时需要吸收40.69 kJ的热量,则H2O(g) H2O(l) 的ΔH = +40.69 kJ·mol-1 H2O(l) 的ΔH = +40.69 kJ·mol-1 |
| B.已知CH4 (g)+2O2(g)=CO2(g)+2H2O(l);△H=-802.33kJ/mol,则CH4的燃烧热为802.33 kJ |
C.H2(g)+Br2(g)=2HBr(g)△H=-72kJ·mol-1其它相关数据如下表: 则表中a为230 |
| D.已知S (g)+O2(g)=SO2(s);△H1,S (g)+O2(g)=SO2(g);△H2,则△H2<△H1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C(s)+1/2O2(g)=CO(g) ΔH=-110.5kJ·mol-1 (燃烧热) |
| B.2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1(反应热) |
| C.C2H5OH+3O2=2CO2+3H2O ΔH=-1368.8 kJ·mol-1(反应热) |
| D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l) ΔH=-114.6 kJ·mol-1(中和热) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
B.由N2O 4(g)  2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ 2NO2(g)△H=" -56.9" kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ |
| C.由:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量为57.3 kJ |
| D.已知101kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221kJ/mol,则1 mol碳完全燃烧放出的热量大于110.5kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.反应①可确定铝的燃烧热是708.7KJ |
| C.O3比O2稳定,由O2变O3为放热反应 |
| D.反应②可确定铝的燃烧热是779.78 kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com