
��ӦN2+3H2 2NH3 �SH= ��92��4 kJ/mol ��һ���¶Ⱥ����������ܱ������н��в��ﵽƽ�⣬������c (N2
)= 2mol/L��c (H2)=5mol/L����Ӧ�ﵽƽ��ʱ��һ���N2�����˷�Ӧ����
2NH3 �SH= ��92��4 kJ/mol ��һ���¶Ⱥ����������ܱ������н��в��ﵽƽ�⣬������c (N2
)= 2mol/L��c (H2)=5mol/L����Ӧ�ﵽƽ��ʱ��һ���N2�����˷�Ӧ����
��1����ﵽƽ��ʱ�� H2��NH3��Ũ�ȷֱ�Ϊc (H2 )= mol/L��c (NH3)= mol/L
��2����ƽ��ʱH2��ת����Ϊ ����ƽ��ʱNH3�����ʵ�����ƽ��������ʵ����ı�ֵΪ
��3������¶��µ�ƽ�ⳣ��Ϊ ���ﵽƽ�������¶ȣ���ƽ�� �������ƣ����ƻ��ƶ�����Kֵ ��H2��ת���� ����������������С�䣩
 ��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
��Ԫ����ĩ��ϰ�ȷ��ϵ�д� ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 2NH3����10s��N2��Ũ����5mol/L����4mol/L����˵����ȷ���ǣ�������
2NH3����10s��N2��Ũ����5mol/L����4mol/L����˵����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 2NH3�������й��ƶ���ȷ���ǣ�������
2NH3�������й��ƶ���ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
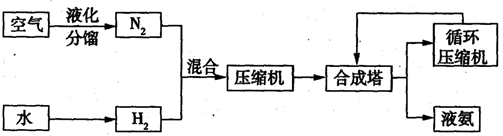
| �������� | ���� | ���� | ���� | ���� | ��� | ��� | ��� |
| �е�/�� | -196 | -183 | -269 | -264 | -186 | -153 | -108 |
| ԭ�� | ��Ȼ�� | ���� | ú |
| ���Ͷ�ʷ��� | 1.0 | 1.5 | 2.0 |
| ��������/J?t-1 | 28��109 | 38��109 | 48��109 |
| ||
| ���� |
| ||
| ���� |
| NH3����% ѹǿ/MPa �¶�/�� |
0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
 2NH3�ġ�H
2NH3�ġ�H| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 2NH3������ѡ�����Ϊ��Ӧ�ﵽƽ��״̬��־���ǣ�������
2NH3������ѡ�����Ϊ��Ӧ�ﵽƽ��״̬��־���ǣ��������鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com