
【题目】将一定量纯净的 X 置于某 10 L 容积恒定的真空容器中(假设固体试样体积忽略不计),在恒定温度下使其达到分解平衡:X(s) ![]() 2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是( )
2Y(g)+Z(g),实验测得不同温度下的分解平衡常数列于下表,下列说法中不正确的是( )
温度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
K/(×10-8 mol3·L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
A.该反应在高温下可能自发
B.若Z的体积分数不再随时间变化时表示反应达平衡状态
C.若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大
D.35℃时,达平衡时,X分解了0.03 mol
【答案】B
【解析】
A、由表可知温度越高,平衡常数K越大,所以反应X(s)2Y(g)+Z(g)为吸热反应,△H>0,反应中气体的物质的量增大,△S>0,根据△G=△H-T△S,反应在高温的条件下能自发进行,故A正确;
B、反应X(s)2Y(g)+Z(g)中,Y和Z都是气体,而X是固体,所以Z的体积分数不随时间变化而变化,所以Z的体积分数不变不能作平衡状态的标志,故B错误;
C、压缩容器体积,相当于增大压强,平衡逆向移动,所以再次达平衡后,n(X)比原平衡大,故C正确;
D、35℃平衡常数为10.8,
X(s)2Y(g)+Z(g),
起始量(mol): a 00
变化量(mol): b2b b
平衡量(mol):a-b2b b
所以K=![]() =10.8,解得:b=0.03 mol,故D正确;
=10.8,解得:b=0.03 mol,故D正确;
故选B。


科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项 | 实验 | 现象 | 结论 |
A. | 向盛有Fe(NO3)2溶液的试管中加入0.1 mol·L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO |
B. | 测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
C. | 向NaHCO3溶液中滴加NaAlO2溶液 | 出现白色沉淀 | 酸性:HCO3->Al(OH)3 |
D. | 向10 mL 0.2 mol·L-1NaOH溶液中滴入2滴0.1 mol·L-1MgCl2溶液,再滴加2滴0.1 mol·L-1FeCl3溶液 | 先有白色沉淀生成后变为红褐色沉淀 | 相同温度下的Ksp:Mg(OH)2>Fe(OH)3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学用语不正确的是
A. 闪锌矿(ZnS)经CuSO4溶液作用后,转化为铜蓝(CuS):ZnS + Cu2+ === CuS + Zn2+
B. 0.1 mol/L 的醋酸溶液pH约为3:CH3COOH ![]() CH3COO- + H+
CH3COO- + H+
C. 电解NaCl溶液,阴极区溶液pH增大:2H2O + 2e- === H2↑+ 2OH-
D. 钢铁发生吸氧腐蚀,负极反应为:Fe-3e- === Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语解释相关现象正确的是( )
A.向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH-
B.常温下,0.1 mol/L的HF 溶液的pH>1:HF+H2O![]() H3O++F-
H3O++F-
C.KHSO4在熔融状态下可导电:KHSO4 = K++H++SO42-
D.BaSO4的水溶液导电性极弱:BaSO4![]() Ba2++SO42-
Ba2++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研究将磷钨酸(H3PW12O40,以下简称HPW)代替浓硫酸作为酯化反应的催化剂,但HPW自身存在比表面积小、易溶于有机溶剂而难以重复使用等缺点,将其负载在多孔载体(如硅藻土、C等)上则能有效克服以上不足,提高其催化活性。用HPW负载在硅藻土上催化制取乙酸正丁酯的酯化率与HPW负载量的关系(温度:120℃,时间:2h)如图所示,下列说法不正确的是

A.与HPW相比,HPW/硅藻土比表面积显著增加,有助于提高其催化性能
B.当HPW负载量为40%时达到饱和,酯化率最高
C.用HPW/硅藻土代替传统催化剂,可减少设备腐蚀等不足
D.不同催化剂对酯化率的影响程度主要取决于化学反应正向进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室探究过渡金属元素化合物的性质
I、铁及其化合物

(1)向FeSO4溶液中滴加NaOH溶液,产生白色沉淀,但迅速变为灰绿色,最终变为红褐色,为顺利看到较长时间的白色沉淀,设计了图①装置:①检查装置气密性,装入药品;②打开止水夹K;③在试管b出口收集气体并验纯;④关闭止水夹K。以上操作正确的顺序是:___。
(2)某实验小组称量3.60 g草酸亚铁晶体(FeC2O4·2H2O)加热过程中,固体质量变化如图②所示:
①请写出AB段发生反应的化学方程式:___。②C点成分为:___。
(3)向FeCl3溶液中加入过量Na2SO3溶液,设计实验证明两者发生了氧化还原反应并且为可逆反应。(简要说明实验步骤、现象和结论,仪器和药品自选)___。
II、铜及其化合物
向2ml0.2mol·L-1Na2SO3溶液中滴加0.2mol·L-1CuSO4溶液,发现溶液变绿,继续滴加产生棕黄色沉淀,经检验,棕黄色沉淀中不含SO42-,含有Cu+、Cu2+和SO32-。
已知:Cu+![]() Cu+Cu2+,Cu2+
Cu+Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
(4)用稀硫酸证实沉淀中含有Cu+的实验现象是___。
(5)向洗净的棕黄色沉淀中加入足量KI溶液,产生白色沉淀,继续向上层清液中加入淀粉溶液并没有变蓝的现象出现,请结合离子反应方程式解释不变蓝的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.2000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1) 配平离子方程式:______MnO4-+HSO3-+H+=Mn2++SO42-+H2O。
(2)用KMnO4进行滴定时,KMnO4溶液应装在_______________中,判断滴定终点的现象是_______。
(3)下列操作会导致测定结果偏高的是_________。
A. 盛装未知浓液的锥形瓶用蒸馏水洗过,未用待测液润洗
B. 未用标准浓度的酸性KMnO4溶液润洗滴定管
C. 观察读数时,滴定前仰视,滴定后俯视
D. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4) 根据下表测定的实验数据,计算KMnO4溶液体积的平均值为___mL;NaHSO3溶液的物质的量浓度为___mol/L(数据精确到0.1)。
试验编号 | 待测NaHSO3溶液的体积/ mL | KMnO4溶液体积/ mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)按系统命名法填写下面有机物的名称: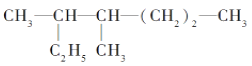 _________________
_________________
(2)2,6-二甲基-4-乙基辛烷的结构简式是______________________,1 mol该烃完全燃烧需消耗氧气________mol。
(3)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加1对共用电子对。试完成下列问题:
①分子式为CnH2n+2的烃分子中碳碳间共用电子对数为________。
②符合该条件的单烯烃的分子式为________。
(4) 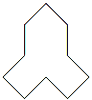 分子式为________,按碳的骨架分,该有机物属于________。(填字母序号)
分子式为________,按碳的骨架分,该有机物属于________。(填字母序号)
a. 环状化合物 b. 脂环烃 c. 芳香化合物 d. 苯的同系物
(5)2,2-二甲基丙烷的习惯命名为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com