
【题目】已知A、B、C、D、E五种物质都含有相同的元素X,这五种物质间相互转化关系如下: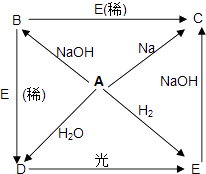
已知A是一种黄绿色气体,由此推断:
(1)这五种物质的化学式为:
A: B: C D: E:
(2)写出水溶液中发生下列化学反应的化学方程式:
A→D:
D→E:
B→D: .
【答案】
(1)Cl2,NaClO,NaCl,HClO,HCl
(2)Cl2+H2O?HCl+HClO,2HClO ![]() O 2↑+2HCl,NaClO+HCl=NaCl+HClO
O 2↑+2HCl,NaClO+HCl=NaCl+HClO
【解析】解:(1)A、B、C、D、E五种物质都含有相同的元素X,A是一种黄绿色气体,则A为Cl2,;氯气与钠反应生成C为NaCl,氯气与氢气反应生成E为HCl,氯气与水反应生成D,D光照可以得到HCl,故D为HClO,氯气与氢氧化钠反应生成B,B与稀盐酸反应生成次氯酸,故B为NaClO。
(2)A→D化学反应的化学方程式:Cl2+H2OHCl+HClO;
D→E化学反应的化学方程式:2HClO ![]() O 2↑+2HCl;
O 2↑+2HCl;
B→D化学反应的化学方程式:NaClO+HCl=NaCl+HClO,
故答案为:(1)Cl2;NaClO;NaCl;HClO;HCl;(2)Cl2+H2OHCl+HClO;2HClO ![]() O 2↑+2HCl;NaClO+HCl=NaCl+HClO
O 2↑+2HCl;NaClO+HCl=NaCl+HClO
本题是对氯气及其化合物的相关转化的综合考查,抓住氯气与相关物质反应的化学方程式,是正确解答此题的关键。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】A、B、C都是金属,把A浸入C的盐溶液中,A的表面有C析出,A与B和酸溶液组成原电池时,B为电池的负极。A.B.C金属的活动性顺序为( )
A. A>B>CB. A>C>BC. B>A>CD. B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 阴、阳离子间通过静电引力而形成的化学键叫做离子键
B. 只有金属元素和非金属元素化合时才能形成离子键
C. 强碱、大多数盐、氧化物中都含有离子键
D. 离子键一定存在于化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
A.X是电源的负极
B.阴极的反应式是:H2O+2eˉ=H2+O2-
CO2+2eˉ=CO+O2-
C.总反应可表示为:H2O+CO2![]() H2+CO+O2
H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是:( )
A. 标准状况下,5.6 L四氯化碳含有的分子数为0.25NA
B. 标准状况下,14 g氮气含有的核外电子数为5NA
C. 标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D. 在标准状况下,18gH2O所含有的电子数不是10 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废铅蓄电池量急速增加所引起的铅污染日益严重.工业上从废铅蓄电池的铅膏中回收铅的工艺流程如图 
(1)铅蓄电池的总反应为Pb+PbO2+2H2SO4═2PbSO4+2H2O,该蓄电池放电时的负极反应式为 , 放电后该电极质量(填“增大”“减小”或“不变”).
(2)步骤①中加入Na2SO3的作用是 .
(3)写出步骤②证明PbCO3沉淀已经洗涤干净的实验操作方法: .
(4)若用NH4HCO3和NH3H2O为脱硫转化剂,也可对上述流程中的含铅渣泥进行处理.图2是NH4HCO3和NH3H2O用量对含铅渣泥中脱硫率的影响:
从图形可以看出,应选择NH4HCO3和NH3H2O用量为理论用量的倍.该条件下步骤③从母液可获得副产品为 .
(5)步骤④使用纯铅和粗铅作电极,PbSiF6作电解质,可进行粗铅精炼.则阳极的电极材料是 , 阴极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.冰、水和水蒸气中都存在氢键
B.除稀有气体外的非金属元素都能生成不同价态的含氧酸
C.金属离子和自由电子间通过金属键形成的晶体是金属晶体
D.CO2的原子晶体和分子晶体互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。
(1)原子序数为29的铜元素位于元素周期表中第 周期。
(2)某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。
(3)研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是
A.降低了反应的活化能
B.增大了反应的速率
C.降低了反应的焓变
D.增大了反应的平衡常数
(4)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为
(5)下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。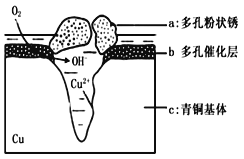
①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 .
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com