
【题目】2017年5月18日,国土资源部部长姜大明在南海神狐海域“蓝鲸一号”钻井平台宣布我国首次海域可燃冰试采成功,实现了历史性突破,预示着我国已经成功达到了未来全球能源发展的制高点。“可燃冰”的主要成分是
A.H2B.C2H4C.COD.CH4
 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】对化学反应限度的叙述,错误的是 ( )
A. 任何可逆反应都有一定的限度
B. 化学反应达到限度时,正逆反应速率相等
C. 化学反应的限度与时间的长短无关
D. 化学反应的限度是不可改变的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 碱金属性质相似,均为银白色(铯除外)的柔软金属,密度都比较小
B. 碱金属单质在空气中燃烧生成的都是过氧化物
C. 碱金属单质的熔沸点随原子序数的增加而升高
D. Li、Na、K都可以保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于过氧化物的叙述正确的是(NA表示阿伏伽德罗常数)( )
A. 7.8g过氧化钠含有的共用电子对数为0.2NA
B. 2H2O2(l)=2H2O(l)+O2(g)ΔH=98.2 kJ/mol,ΔS=70.5 J/mol·K,该反应低温能自发进行
C. 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子
D. 在含有NH4+、Ba2+、Cl—、NO3—离子的溶液 加入少量过氧化钠以上各离子量几乎不减少
【答案】B
【解析】
A.过氧化钠的电子式为![]() ,则7.8g过氧化钠含有的共用电子对为
,则7.8g过氧化钠含有的共用电子对为![]() ×1=0.1mol,故A错误;B.2H2O2(l)=2H2O(l)+O2(g)△H=-98.2kJmol-1,△S=70.5Jmol-1K-1,则△G=△H-T△S<0在任何温度下都小于0,故B正确;C.过氧化氢遇强氧化剂酸性高锰酸钾溶液时,过氧化氢中的氧元素的化合价是-1价可升高为0价,发生还原反应,所以1mol过氧化氢失去2NA电子,故C错误;D.过氧化钠与水反应生成氢氧化钠和氧气,氢氧根与NH4+反应生成氨水,所以NH4+会减小,故D错误;故选B。
×1=0.1mol,故A错误;B.2H2O2(l)=2H2O(l)+O2(g)△H=-98.2kJmol-1,△S=70.5Jmol-1K-1,则△G=△H-T△S<0在任何温度下都小于0,故B正确;C.过氧化氢遇强氧化剂酸性高锰酸钾溶液时,过氧化氢中的氧元素的化合价是-1价可升高为0价,发生还原反应,所以1mol过氧化氢失去2NA电子,故C错误;D.过氧化钠与水反应生成氢氧化钠和氧气,氢氧根与NH4+反应生成氨水,所以NH4+会减小,故D错误;故选B。
【题型】单选题
【结束】
19
【题目】常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是

A. b点溶液中离子浓度由大到小的顺序为: c(Na+)>c(SO42—)>c(NH4+)>c(H+)>c(OH-)
B. 图中b、c、d 三点溶液中水的电离程度最大的是c点
C. b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D. pH=7时,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42—)+c(OH-)
【答案】C
【解析】
试题A.b点表示NH4HSO4溶液与NaOH溶液恰好反应生成硫酸钠、硫酸铵,溶液显酸性,离子浓度由大到小的顺序为:c(Na+)=c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-),故A错误;B.图中b点硫酸铵水解,促进水的电离、c点显中性,生成了部分NH3·H2O,抑制了水的电离、d点氢氧化钠过量,抑制水的电离,三点溶液中水的电离程度最大的是a点,故B错误;C.b点后滴加NaOH溶液过程中,NH3·H2O的浓度逐渐增大,电离程度逐渐减小,故C正确;D.pH=7时,溶液中存在电荷守恒c(H+)+c(Na+)+c(NH
)>c(H+)>c(OH-),故A错误;B.图中b点硫酸铵水解,促进水的电离、c点显中性,生成了部分NH3·H2O,抑制了水的电离、d点氢氧化钠过量,抑制水的电离,三点溶液中水的电离程度最大的是a点,故B错误;C.b点后滴加NaOH溶液过程中,NH3·H2O的浓度逐渐增大,电离程度逐渐减小,故C正确;D.pH=7时,溶液中存在电荷守恒c(H+)+c(Na+)+c(NH![]() )=2c(SO
)=2c(SO![]() )+c(OH-),故D错误;故选C。
)+c(OH-),故D错误;故选C。
考点:考查了弱电解质的电离平衡、离子浓度的大小比较的相关知识。
【题型】单选题
【结束】
20
【题目】下列有关电解质溶液的说法正确的是
A.Na2SO3溶液加水稀释后,pH和KW均减小
B.0.1molL﹣1Na2CO3溶液中:c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3)
C.浓度分别为0.2molL﹣1和0.1molL﹣1的CH3COOH溶液中,c(H+)之比等于2:1
D.室温下,PH=12的氨水与PH=2的H2SO4溶液等体积混合后,溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
【答案】A
【解析】放电相当于原电池,充电相当于电解池。充电是把电能转化为化学能,B不正确。放电时负极反应式为Cr-2e-+2OH-=Cr(OH)2,所以负极附近溶液的碱性减弱,C不正确。在原电池中阳离子向正极移动,阴离子向负极移动,D不正确。答案是A。
【题型】单选题
【结束】
26
【题目】根据所学知识完成题目:
(1)某课外活动小组同学用图1装置进行实验,试回答下列问题:
①若开始时开关K与a连接,则铁发生电化学腐蚀中的___腐蚀.请写出正极反应式:___ .
②若开始时开关K与b连接时,两极均有气体产生,则N端是电源的___极(填正或负),则总反应的离子方程式为___ .
(2)该小组同学设想,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠.
①制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)___导出.通过阴离子交换膜的离子数___(填“>”、“<”或“=”)通过阳离子交换膜的离子数.
②通电开始后,阴极附近溶液pH会增大,请简述原因:___ .
【答案】 吸氧 O2+4e﹣+2H2O=4OH﹣ 负 2Cl﹣+2H2O ![]() 2OH﹣+H2↑+Cl2↑ D < H+在阴极放电,水的电离平衡正向移动,溶液中OH﹣浓度增大,pH增大(合理即可)
2OH﹣+H2↑+Cl2↑ D < H+在阴极放电,水的电离平衡正向移动,溶液中OH﹣浓度增大,pH增大(合理即可)
【解析】(1)①若开始时开关K与a连接,该装置构成原电池,发生电化学腐蚀中的吸氧腐蚀,正极上氧气发生还原反应;②若开始时开关K与b连接时,两极均有气体产生,则Fe作阴极,石墨作阳极,阳极上氯离子放电、阴极上氢离子放电。
(2)①阴极上氢离子放电,则NaOH在阴极生成;根据阴阳离子的移动方向,通过相同电量时,阴阳离子交换的个数判断;②水电离生成的氢离子放电,而氢氧根离子不放电。
(1)①开关K与a连接,为原电池,NaCl溶液为中性,发生吸氧腐蚀,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O=4OH-,故答案为:吸氧;O2+4e-+2H2O=4OH-;
②K与b连接,为电解池,若开始时开关K与b连接时,两极均有气体产生,则Fe作阴极,石墨作阳极,氯离子、氢离子放电,则N为电源负极,电解的总离子反应为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(2)①阴极上氢离子放电,则NaOH在阴极生成,由图可知,D在阴极附近,制得的氢氧化钠溶液从D出口导出;阳极氢氧根离子放电,因此硫酸根离子向阳极移动,阴极氢离子放电,因此钠离子向阴极移动,所以通过相同电量时,通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数,故答案为:D;<;
②水电离出的氢离子在阴极放电,而氢氧根离子不放电,促进水的电离,导致溶液中氢氧根离子浓度增大,溶液的pH增大,故答案为:H+在阴极放电,水的电离平衡正向移动,溶液中OH-浓度增大,pH增大(合理即可)。
【题型】综合题
【结束】
27
【题目】在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:

(1)根据上图数据,反应开始至达到平衡时,CO2的化学反应速率为v(CO2)=___mol/(Lmin);反应达平衡时,c(H2O)=___ mol/L,该温度下的平衡常数K=___ .
(2)判断该反应达到平衡的依据是___ .
①正、逆反应速率都为零
②CO减少的化学反应速率和CO2减少的化学反应速率相等
③CO、H2O、CO2、H2的浓度都相等
④CO、H2O、CO2、H2的浓度都不再发生变化
(3)如要一开始加入0.1mol的CO、0.1mol的H2O、0.1mol的CO2和0.1mol的H2,在相同的条件下,反应达平衡时,c(H2)=___mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我们生活中处处都与化学有密切关系。
(1)洪灾过后,饮用水可用漂白粉消毒。
①工业上将氯气通入石灰乳 [Ca(OH)2]中制取漂白粉,反应的化学方程式为_______________________。
②Cl2是一种有毒气体,如果泄漏会造成严重的环境污染。化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为3Cl2(g)+8NH3(g)=6NH4Cl+N2(g),若反应中消耗Cl21.5mol,则被氧化的NH3的体积为_______________________L(标准状况)。
(2)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐为重要化合物。
①电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式:______________________________________________;如何检验FeCl3腐蚀铜后的溶液是否含Fe3+_______________________________________。
②高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有可逆反应:![]() ,下列各条件的叙述中,能表明反应已达,平衡状态的是( )
,下列各条件的叙述中,能表明反应已达,平衡状态的是( )
A. 各物质的物质的量浓度比为2:1:1
B. 压强保持不变的状态
C. 断裂2 mol H-I键的同时生成1 mol I-I键
D. 混合物中各组成成分的含量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积固定的2L密闭容器中,一定条件下发生如下反应:X(g)+2Y(g)nZ(g),反应过程中各物质的量与时间的关系如图所示.完成下列填空:
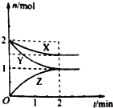
(1)n=______;
(2)Y的平衡浓度为_______;
(3)反应开始至平衡,X 的反应速率v(X)=______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关氧化还原反应的理解正确的是( )
A. 在一定条件下,氯酸钾与碘发生反应KClO3+I2=2KIO3+Cl2 由此判断氧化性 I2>Cl2
B. 已知反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O其中1mol氧化剂在反应中得到的电子为12 mol
C. (NH4)2SO4在高温下分解生成 SO2、H2O、N2和 NH3。则该反应的氧化产物:还原产物=1:3
D. 在反应2CuFeS2 + O2 = Cu2S + 2FeS + SO2中,若有1molO2参加反应,则反应中有4mol电子转移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com