
ij��Һ����Fe2+��Na+��Al3+��Ba2+��SO42����NO3����Cl���е�4�����ӣ��������ӵ����ʵ�����Ϊ1mol���������Һ�м��������ϡ���ᣬ���������������Һ������������䣨������ˮ�ĵ�������ӵ�ˮ�⣩������˵������ȷ���ǣ�������
�� A�� ����Һ�������������ǣ�Fe2+��Na+��SO42����NO3��
�� B�� �������Һ�м��������ϡ���ᣬ�����������ڿ������ܱ�ɺ���ɫ
�� C�� �������Һ�м��˹�����ϡ�����KSCN��Һ����Һ��Ѫ��ɫ
�� D�� �������Һ�м���������NaOH��Һ����ַ�Ӧ���ˡ�ϴ�ӡ����գ��������ù��������Ϊ72g
���㣺 �������ӵļ��鷽����
ר�⣺ ���ӷ�Ӧר�⣮
������ �����Һ�м��������ϡ���ᣬ�����ݲ���������Һ������������䣬��һ������Fe2+��NO3����������ԭ��Ӧ������������NO������������䣬��ԭ��Һ�д���SO42��������Һ�к����������ӣ��������ӵ����ʵ�����Ϊ1mol���ɵ���غ��֪�����д�һ����λ����ɵ������ӣ��Դ������
��� �⣺�����Һ�м��������ϡ���ᣬ�����ݲ���������Һ������������䣬��һ������Fe2+��NO3����������ԭ��Ӧ������������NO������������䣬˵��ԭ��Һ��ԭ���Ѿ�����SO42��������Һ�к����������ӣ���Ӧ������Fe3+���������ӵ����ʵ�����Ϊ1mol���ɵ���غ��֪�����д�һ����λ����ɵ������ӣ���һ������Na+��
A���������ƶϿ�֪������Һ������������Ϊ��Fe2+��Na+��SO42����NO3������A��ȷ��
B�����ɵ�NO�ױ������е����������ɺ���ɫ�Ķ�����������B��ȷ��
C������Һ�м��ᷢ��������ԭ��Ӧ�������������ӣ�����KSCN��Һ������Һ��Ѫ��ɫ����C��ȷ��
D���������Һ�м���������NaOH��Һ����ַ�Ӧ���ˡ�ϴ�ӡ����գ��������ù���Ϊ��������������Ϊ��0.5mol��160g/mol=80g����D����
��ѡ��D��
������ ���⿼�����ӵļ��飬��ȷ�������ӵ����ʼ������з����Ļ�ѧ��Ӧ�ǽ����Ĺؼ���ע�������Ӧ�ų����ӵ����������𣬲�ע�����ӹ��漰����غ��Ӧ�ã���Ŀ�Ѷ��еȣ�
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��298Kʱ������Ӧ���й����ݣ�
C��s��+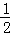 O2��g��=CO��g����H1=﹣110.5kJ/mol
O2��g��=CO��g����H1=﹣110.5kJ/mol
C��s��+O2��g��=CO2��g������H2=﹣393.5kJ/mol
��C��s��+CO2��g��=2CO��g���ġ�H Ϊ��������
�� A�� 283.5kJ/mol B�� 172.5kJ/mol C�� ﹣172.5kJ/mol D�� ﹣504 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����¹�̷ۡ��¼������ܹ㣬�ݵ���ijЩ��ũΪ��������̵ġ������ʡ���������������˵������谷C3H6N6������ͼ���������谷�������غϳɣ�����˵��������ǣ�������
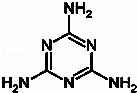
�� A�� �������˹��ϳɵĵ�һ���л���
�� B�� �����谷���Ƿ����廯����
�� C�� �����谷���ڰ�����
�� D�� ���ú������谷���̷ۻᵼ������ʯ
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ����������Һ��ֻ���ܺ��д�����Fe3+��Fe2+��H+��AlO2����Al3+��CO32����NO3�����������еļ��֣������Һ����μ���һ����1mol/L NaOH��Һ�Ĺ����У���ʼû�г�����������г������������ж���ȷ���ǣ�������
�� A�� ��Һ�п��ܺ���AlO2��
�� B�� ��Һ�п��ܺ���NO3��
�� C�� ��Һ��һ������Fe2+��Fe3+
�� D�� ��Һ�п��ܺ���Fe3+����һ������Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ˮ��Һ��ֻ������K+��Mg2+��AlO2����SiO32����CO32����SO42���е����������ӣ�ijͬѧ����Һ��������ͼʵ�飺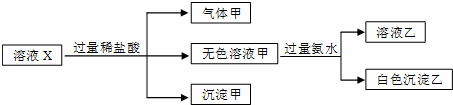
�����жϴ�����ǣ�������
�� A�� ����������ɣ�������ҺX��һ������CO32��
�� B�� �����ײ������ǹ���þ
�� C�� Al3+һ����������ҺX��
�� D�� ������ȷ��SO42���Ƿ��������ҺX��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ҵ��ˮ�п��ܺ������¼����������ӣ�
������ Fe3+��Al3+��Fe2+��Ba2+��Na+
������ Cl����CO32����NO3����SO42����SiO32��
�ֶԸ÷�ˮ��Ʒ���������о���
�����Թ��еμ�Ũ���ᣬ����������ɫ�������ɣ�����������������Ϊ����ɫ��
����������õ���Һ�м���BaCl2��Һ���а�ɫ�������ɣ�
����������õ���Һ�м��������NaOH��Һ���к��ɫ�������ɣ����˺���������Һ��ͨ�������CO2���壬�а�ɫ��״�������ɣ�
��������ʵ�飬�ش��������⣺
��1���÷�ˮ��һ�����е���������������һ�������е�������������
д�����������Һ��ͨ�������CO2�������ɰ�ɫ��״���������ӷ���ʽ��ֻд��һ����������
��3����֪�����ۿ��Գ�ȥ��ˮ�е�һ�������ӣ�X������������Һ��pHΪ10.7���ң��ټ������ۣ���ȥX���ӵ�ͬʱ���������͵������������Ϊ1�s4��������з�Ӧ�����ӷ���ʽ����ƽ����X�þ�������ӷ��ű�ʾ��
����Al+����X+��7��OH��=����AlO2��+����NH3+����N2+��2H2O�����÷�Ӧ�Ļ�ԭ��������������ȥ0.2molX���ӣ�Ҫ����������g��
��4��������ˮ�е���Ԫ����ȫת����Fe3+����ʱ���c��Fe3+��=1.0��10��2mol•L��1��Ҫ�뽫��ת��ΪFe��OH��3��������ȥ����Ӧ������ҺpH���ٴ�������������֪������Fe��OH��3��Ksp=1.0��10��38��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������������������γ��������Ҫ���ʣ�ij�������п��ܺ����������ӣ�Na+��Ba2+��NH4+��Al3+��Cl����SO32����SO42����NO3���ȣ�ij�о�С��ȡ�õ�һ���������꣬Ũ�������ó�����Һ�ֳ�3�ݣ���������ʵ����
���� �����Լ� ʵ������
��һ����Һ �μ������ĵ���KI��Һ ����ɫ
�ڶ�����Һ �μ��������λ���BaCl2��Һ �а�ɫ����
��������Һ �μ���Һ�����ȣ����������������Һ�����V�������ɵij����������������ϵ��n������ͼ�� 
��ش��������⣺
��1������ʵ�����жϸ������п϶������ڵ�������������
д����Һ�еμӵ���KI��Һ��������Ӧ�����ӷ���ʽ������
��3�����ʵ�鷽�����������Һ���Ƿ����Cl��������
��4�����о�С��Ϊ��̽��NO�����������������γɣ�����ƿ�г��뺬������NO��SO2���壬������ͨ��O2��������ѧ��Ӧ����������������ˮ�������������꣬��NO��������Ӧ�е�������������
��5����0.5L�ܱ������ڼ���NO2��SO2��Ϊ�˲ⶨ��ij�ִ��������·�Ӧ��NO2��g��+SO2��g��⇌NO��g��+SO3��g���ķ�Ӧ���ʣ���t0C�����崫������ò�ͬʱ���NO2��SO2Ũ����������������¶ȱ仯�Դ�����Ч�ʵ�Ӱ�죩��
ʱ��/s 0 1 2 3 4 5
c��NO2��/mol•L��1 1.00��10��3 4.50��10��4 2.50��10��4 1.50��10��4 1.00��10��4 1.00��10��4
c��SO2��/mol•L��1 3.60��10��3 3.05��10��3 2.85��10��3 2.75��10��3 2.70��10��3 2.70��10��3
��ǰ2s��NO��ƽ����Ӧ����v��NO��=����
��t��÷�Ӧ�Ļ�ѧƽ�ⳣ��K=������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������£������Ϊ3L���ܱ������У�һ����̼��������Ӧ���ɼ״�������ΪCu2O/ZnO����CO��g��+2H2��g��⇌CH3OH��g����������������������⣺
��1����Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽK=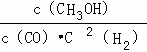 ���������¶ȣ�Kֵ��С�����������С�����䡱����ƽ�����淴Ӧ�����ƶ���
���������¶ȣ�Kֵ��С�����������С�����䡱����ƽ�����淴Ӧ�����ƶ���
��2����500�棬�ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v��H2��=��
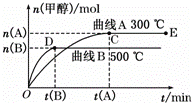
��3���������������������£�������E�����ϵ���ѹ����ԭ����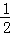 �������йظ���ϵ��˵����ȷ���� ��ѡ��ѡ����ĸ����
�������йظ���ϵ��˵����ȷ���� ��ѡ��ѡ����ĸ����
A��������Ũ�ȼ���
B������Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ�
C���״������ʵ�������
D������ƽ��ʱ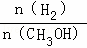 ����
����
��4�����о�����Ӧ������������õ�ΪCu2O����Ӧ��ϵ�к�����CO2������ά�ִ���Cu2O�������䣬ԭ���� ���û�ѧ����ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪����N2��g��+3H2��g�� 2NH3��g����H��0��
2NH3��g����H��0��
��2SO2��g��+O2��g�� 2SO3��g����H��0����ش��������⣺
2SO3��g����H��0����ش��������⣺
��1����Ӱ�컯ѧ��Ӧ���ʺͻ�ѧƽ������ط�����Ҫ������NH3��SO3�����ɣ�������Ӧ��ȡ�Ĵ�ʩ���ʵ��¶ȡ���ѹ��������ʵ�������в�ȡ�Ĵ�ʩ���ϳɰ����������ϳ�SO3��������
��2���ںϳɰ��Ĺ�ҵ�����У�Ҫ���������Ŀ�������������ϳ�SO3�Ĺ����У�����Ҫ�����SO3��ԭ����������
��3����0.050mol SO2��g����0.030mol O2��g�������ݻ�Ϊ1L���ܱ������У���Ӧ����һ�������´ﵽƽ�⣬���c��SO3��=0.040mol•L﹣1������������·�Ӧ�ڵ�ƽ�ⳣ��K=������
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com