
按要求书写
(1)H2CO3的电离方程式
(2)NaHSO3的电离方程式
(3)NH4Cl水解的离子方程式
(4)向Na2CO3溶液中滴加酚酞呈红色的原因是 (用离子方程式表示); 溶液中各离子浓度由大到小的顺序 ;向此溶液中加入AlCl3溶液,观察到的现象是 ,反应的离子方程式为 .
考点:
电离方程式的书写;盐类水解的应用.
专题:
电离平衡与溶液的pH专题.
分析:
(1)碳酸属于多元弱酸存在分步电离,电离过程是可逆过程;
(2)亚硫酸氢钠属于强电解质,完全电离出钠离子和亚硫酸氢根离子;
(3)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性;
(4)Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32﹣+H2O⇌HCO3﹣+OH﹣,Na2CO3溶液中存在c(Na+)>c(CO32﹣)>c(OH﹣)>c(HCO3﹣)>c(H+),碳酸钠与强酸弱碱盐氯化铝发生双水解反应,以此来解答.
解答:
解:(1)H2CO3为多元弱酸,分步电离,则电离方程式为H2CO3⇌H++HCO3﹣、HCO3﹣⇌H++CO32﹣,
故答案为:H2CO3⇌H++HCO3﹣、HCO3﹣⇌H++CO32﹣;
(2)亚硫酸属于弱酸,亚硫酸氢根离子部分电离,所以亚硫酸氢钠完全电离出钠离子和亚硫酸氢根离子,电离方程式为:NaHSO3=Na++HSO3﹣,
故答案为:NaHSO3=Na++HSO3﹣;
(3)氯化铵是强酸弱碱盐,铵根离子水解导致溶液呈酸性,其水解离子方程式为NH4++H20⇌NH3•H2O+H+,
故答案为:NH4++H20⇌NH3•H2O+H+;
(4)Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32﹣+H2O⇌HCO3﹣+OH﹣,HCO3﹣+H2O⇌H2CO3+OH﹣,因CO32﹣水解水解显碱性,且第一步水解大于第一步电离,则离子浓度关系为:c(Na+)>c(CO32﹣)>c(OH﹣)>c (HCO3﹣)>c(H+);向此溶液中加入AlCl3溶液,氯化铝属于强酸弱碱盐,两者发生双水解反应,现象为:
有气泡及白色沉淀产生,溶液红色逐渐变浅至颜色消失;方程式为:2Al3++3CO32﹣+3H2O=2Al(OH)3↓+3CO2↑,
故答案为:CO32﹣+H2O⇌HCO3﹣+OH﹣,HCO3﹣+H2O⇌H2CO3+OH﹣;c(Na+)>c(CO32﹣)>c(OH﹣)>c (HCO3﹣)>c(H+);有气泡及白色沉淀产生,溶液红色逐渐变浅至颜色消失;2Al3++3CO32﹣+3H2O=2Al(OH)3↓+3CO2↑.
点评:
本题考查了电离与水解方程式的书写,为高频考点,注意遵循电荷守恒和质量守恒定律,把握发生的化学反应及电解质的强弱及电离特点是解答的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列各选项中所述的两个量,前者一定大于后者的是 ( )
A.1 L 0.3 mol/L CH3COOH溶液和3 L 0.1 mol/L CH3COOH溶液中的H+数
B.pH=1的CH3COOH溶液和盐酸的物质的量浓度
C.pH=12的氨水和NaOH溶液的导电能力
D.pH相同的等体积的盐酸和醋酸溶液分别与足量锌粒反应产生的气体体积
查看答案和解析>>
科目:高中化学 来源: 题型:
发射卫星用N2H4作燃料,NO2作氧化剂,两者反应生成N2和水蒸气,
已知:N2(g)+O2(g)=2NO2(g)△H1=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=﹣534kJ/mol
试写出N2H4与 NO2反应的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述中,正确的是( )
|
| A. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(1)△H=+57.3kJ/mol |
|
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 |
|
| C. | 已知2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ |
|
| D. | 已知C(s)+O2(g)=CO2(g)△H1;C(s)+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
|
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
|
| C. | 用0.2000mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和 |
|
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在稀硫酸和稀盐酸的混合溶液100mL中,加入固体Ba(OH)24.275g,充分反应后,测得溶液的pH为13(设溶液体积不变),再经过滤得干燥沉淀物2.33g.求原溶液中SO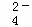 、Cl﹣、H+的物质的量浓度分别是多少?
、Cl﹣、H+的物质的量浓度分别是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,取100 mL某酸溶液,测得其pH等于1,下列叙述正确的是 ( )。
A.该溶液中的c(H+)≥0.1 mol·L-1
B.把该溶液稀释成1 L后,pH≥2
C.把该溶液稀释成1 L后,pH<2
D.完全中和此溶液需0.1 mol·L-1 NaOH的体积≥100 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出).
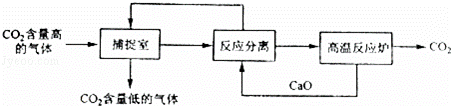
下列有关该方法的叙述中不正确的是()
A. 能耗大是该方法的一大缺点
B. 整个过程中,有2种物质可以循环利用
C. “反应分离”环节中,分离的基本操作是蒸发结晶、过滤
D. “反应分离”环节中,发生了复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com